Laboratoryjny fermentator - bioreaktor
Laboratoryjny fermentator - bioreaktor
Innowacja prowadzi do fermentatora wysokiej jakości przy niskich kosztach. LAMBDA MINIFOR wprowadza nowe koncepcje w laboratoryjnej fermentacji i kulturach komórkowych:
Stołowy fermentator-bioreaktor laboratoryjny LAMBDA MINIFOR
Stołowy fermentator-bioreaktor LAMBDA MINIFOR został opracowany w odpowiedzi na potrzebę skonstruowania małego laboratoryjnego fermentatora o objętości od 35 ml do ponad 6 litrów. Bazując na wieloletnim osobistym doświadczeniu w fermentacji chcieliśmy stworzyć fermentator, który byłby łatwy w obsłudze oraz posiadał zdolność pomiaru i kontroli wszystkich ważnych biologicznych parametrów kultury.
Fermentator powinien zajmować minimum przestrzeni, ale z dobrym dostępem do wszystkich części.Kilka fermentatorów powinno dać się ustawić obok siebie w celu optymalizacji parametrów wzrostu lub optymalizacji biotransformacji.
Każdy fermentator powinien być w stanie pracować niezależnie lub móc być podłączony do komputera w celu zaawansowanych regulacji i intensywnej obróbki danych.
Aby utrzymać niski koszt fermentora-bioreaktora MINIFOR nie tracąc na jego jakości zostało wprowadzone kilka nowych pomysłów i innowacji:
Zamiast kosztownej kolby fermentatora z pokrywą ze stali nierdzewnej zostały zastosowane naczynia w całości szklane z gwintowanymi złączkami. Stosowane są one przez wiele lat w hodowlach komórkowych i okazało się, że utrzymują idealną sterylność. Dzięki tej koncepcji fermentator-bioreaktor MINIFOR można złożyć w krótkim czasie.
Zamiast tradycyjnego mieszadła śrubowego, który wymaga kosztownego silnika i sprzęgła magnetycznego, wprowadziliśmy mieszanie „up-and-down”. Silnik wraz z niedrogimi membranami zapewnia doskonałą sterylność i skuteczne mieszanie bez formowania wiru (nie są potrzebne przegrody). Jednocześnie ten rodzaj mieszania jest łagodniejszy dla komórek i produkuje mniej piany. Nowe „biomickingowe” mieszadła w kształcie „rybiego ogona” zapewniają maksymalną wydajność bez obecności krawędzi tnących.
Kultury są podgrzewane przez promieniowanie cieplne emitowane przez radiator ze złotym reflektorem umieszczonym pod naczyniem fermentacyjnym. Ciepło jest pochłaniane łagodnie przez kulturę podobnie jak słońce ogrzewa wodę. Nie występuje przegrzewanie kultury w jakiejkolwiek objętości i zlikwidowane są kosztowne naczynia z podwójną ścianką do kąpieli w łaźnie wodnej. Jednocześnie nie są obecne rurki i przewody co czyni fermentator mniej skomplikowanym.
W miarę możliwości drogie elementy wyposażenia zostały zastąpione nowymi wysokiej jakości elementami plastikowymi.
Przy użyciu nowoczesnych mikroprocesorów możliwe było umieszczenie wszystkich elementów elektronicznych w przedniej części urządzenia. Sprawia to, że fermentor jest niezwykle kompaktowy i eliminuje wysoką osłonę obudowy. Pomimo niewielkich rozmiarów mierzonych i kontrolowanych jest sześć parametrów w podstawowej konfiguracji MINIFOR.
Opis techniczny
Jednostka bazowa

Główną zaletą MINIFOR jest to, że wszystkie elementy elektroniczne, zasilacz, promiennik podczerwieni, zawór powietrza, miernik przepływu, kable i przewody są zintegrowane w jednej stacji bazowej, która jest wykorzystywana jako podstawa dla naczynia fermentacyjnego i innych akcesoriów. Układ platformy stacji bazowej sprawia, że wszystkie części fermentora są wyraźnie widoczne i łatwo dostępne ze wszystkich stron pomimo wymiarów bazy wynoszących tylko 22 x 40 cm (ok. A4 arkuszy papieru).
Do pięciu butelek z odczynnikami może być umieszczonych w magnetycznych uchwytach z tyłu naczynia fermentacyjnego oraz do czterech pomp w regulowanych uchwytach zamocowanych na prętach w tylnej części jednostki bazowej. Gniazda znajdują się na tylnej części jednostki bazowej eliminując tym samym kable z miejsca pracy.
Pomiary i regulacja

Panel sterowania składa się z wyświetlacza LCD oraz przycisków. Wszystkie parametry (temperatura, pH, pO2, przepływ powietrza, mieszanie i jeden parametru do wyboru, np. pCO2, gęstość optyczna, przeciwpienny itp.) są widoczne na pierwszy rzut oka na dużym podświetlanym wyświetlaczu LCD (4 × 40 cyfr). Sterowanie jest proste i intuicyjne.
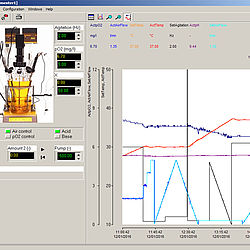
Dla większości parametrów może zostać ustawiony alarm dla granicznych (niskich i wysokich) wartości. Po aktywacji alarmu następuje emisja sygnału dźwiękowego oraz pojawia się informacja na wyświetlaczu. Każdy fermentor może być obsługiwany w sposób niezależny lub może być połączony z komputerem (przez RS 485 łub RS 232) z wykorzystaniem specjalnego programu do fermentacji FNet (do 6 fermentorów równolegle) lub oprogramowanie SIAM. Ten ostatni pozwala na niemal nieograniczone możliwości kontroli i przetwarzania danych.
Naczynie fermentacyjne

Standardowe naczynie fermentacyjne posiada objętość roboczą do 1,7 litra (inne naczynia o objętościach roboczych od 35 ml do max 6 litrów mogą być również dostarczone). Naczynia są wykonane z wysokiej jakości szkła Pyrex z jednym dużym centralnie ułożonym gwintowanym otworem do mocowania membrany i wibracyjnego mieszalnika oraz 6 do 8 gwintowanych szyj przeznaczonych do podłączenia różnych czujników, ujścia powietrza, poboru próbek, podania szczepionek, itp. Regulowany uchwyt utrzymuje naczynie w stałej pozycji. Naczynie fermentacyjne sterylizuje się w autoklawie.
Wymiary
Włożone wiele starań, aby kompaktowe urządzenie MINIFOR było jak najmniejsze. Układ platformy fermentora pozwala na łatwą kontrolę i dostęp do wszystkich części ze wszystkich stron. Odległości pomiędzy butelkami z odczynnikami, pompami i naczyniem fermentacyjnym są możliwe najmniejsza.
Mieszanie
Zamiast tradycyjnego mieszadła śmigłowego w bioreaktorze zostało wykorzystane nowe mieszadło wibracyjne. Mocny silnik porusza jeden lub więcej dysków mieszających w górę i w dół. Główną zaletą jest skuteczne mieszanie i napowietrzanie pożywki hodowlanej wraz z wysoce kompletnym oddzieleniem wnętrza zbiornika od środowiska zewnętrznego poprzez niedrogą membranę silikonową. Nie powstaje wir i przegrody są wyeliminowane. Ten typ mieszania jest łagodniejszy dla komórek i pienienie jest zmniejszone. Bardzo skuteczne mieszanie uzyskuje się dzięki wprowadzeniu nowatorskiego elastycznego mieszadła w kształcie „rybiego ogona”. Pozwala to na uzyskanie maksymalnej wydajności mieszania bez obecności krawędzi tnących – jest to optymalny wybór dla kultur komórkowych. Częstotliwość mieszania jest sterowana przez mikroprocesor i może być zmieniana w szerokim zakresie. Wejście powietrza odbywa się poprzez elastyczną samoczyszczącą się mikro-bełkotkę.
Regulacja temperatury
Nowy promiennik podczerwieni (IR) z pozłacanym parabolicznym reflektorem służy do ogrzewania brzeczki hodowlanej. Promieniowanie cieplne (150 W) koncentruje się na dnie zbiornika gdzie jest absorbowane przez medium w sposób podobny do ogrzewania wody przez słońce. Nie występuje przegrzanie w jakiejkolwiek objętości (powszechne gdy grzałki są umieszczone bezpośrednio w medium hodowlanym). Dzięki niskiej przepustowości cieplnej źródła promieniowania podczerwieni możliwość przekroczenia temperatury jest zmniejszona, a temperatura może być dokładniej kontrolowana. Czujnik temperatury jest umieszczony bezpośrednio w czujniku pH i jest używany jednocześnie do automatycznej regulacji elektrody pH i pO2.
Pomiar i kontrola pH

Wartość pH mierzy się za pomocą sterylizowalnej elektrody pH z wbudowanym czujnikiem temperatury. Dzięki wykorzystaniu wtyczki VarioPin może być sterylizowana bez żadnej ochrony. Dwupunktowa kalibracja elektrody jest półautomatyczna. Wartość pH ma automatyczną korekcję temperatury. Dodanie kwasu lub zasady jest sterowane przez mikroprocesor. Szybkość przepływu pomp perystaltycznych PRECIFLOW, MULTIFLOW, HIFLOW lub MAXIFLOW jest zróżnicowana w zakresie od 0 do 100 %, co sprawia, że kontrola pH przebiega płynniej niż w powszechnie występujących pompach o stałej prędkości przepływu. Unikalny PUMP FLOW INTEGRATOR (opcjonalnie) w połączeniu z pompą umożliwia monitorowanie aktywności pompy podczas procesu. Daje to dokładne dane kinetyczne dotyczące stanu kultury i jej aktywności.
Pomiar i regulacja pO2
![]()
Sterylizowalna elektroda typu Clark o dużej mierzalności stężenia tlenu rozpuszczonego wykonana ze szkła wzmocnionego teflonową membraną daje szybki czas reakcji i krótką polaryzację. Główna część membrany jest chroniona przed urazami mechanicznymi przez cienką ściankę PEEK. Mikroprocesor wykonuje półautomatyczną dwupunktową kalibrację z automatyczną kompensacją temperatury. Regulację rozpuszczonego tlenu uzyskuje się przez zmianę szybkości przepływu powietrza.
Wejście powietrza
Przepływ można ustawić od 0 do 5 l/min w 0,01 l/min odstępach. Został użyty precyzyjny miernik przepływu mas. Pomiar ten jest niezależny od ciśnienia i zmian temperatury powietrza. Powszechnie stosowane rotametry nie dają w tym przypadku dokładnych odczytów. Zastrzeżony proporcjonalny zawór powietrza reguluje przepływ ciągły.
Została opracowana nowa samooczyszczająca się elastyczna mikro-bełkotka. Jej specjalna konstrukcja umożliwia automatyczną eliminację osadów solnych, które blokują przepływ powietrza w normalnych bełkotkach. Jest to szczególnie ważne dla mikro-bełkotek o bardzo wąskich kanałach.
Wyjście powietrza
Zużyte powietrza jest chłodzone w szklanej chłodnicy ze szkła i filtrowane przez filtr PTFE (teflon). Opcjonalny kondensator Peltiera, który nie wymaga chłodzenia wodą, może być stosowany do usuwania pary wodnej ze strumienia powietrza.
Szczepienie i pobieranie próbek
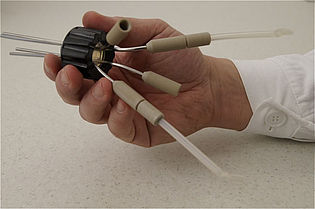
Szczepienie, dodawanie kwasu lub zasady oraz pobieranie próbek odbywa się za pośrednictwem czterech kapilar ze stali nierdzewnej wyposażonych w podwójne uszczelnienie LAMBDA PEEK.
Wysokiej jakości pompy perystaltyczne

Do czterech wysokiej jakości pomp perystaltycznych PRECIFLOW, MULTIFLOW, HIFLOW lub MAXIFLOW może zostać umieszczonych w uchwytach zamocowanych na dwóch prętach w tylnej części fermentatora. Połączone są one za pomocą jednego przewodu do gniazda z tyłu fermentatora. Ponieważ pompy nie są zintegrowane z fermentorem mogą być wykorzystywane do innych zastosowań laboratoryjnych (np. chromatografii). Stanowi to znaczne oszczędności dla użytkownika.
Nowy system połączenia zapewnia podwójne uszczelnienie rurki w związku z tym, silnie zmniejsza prawdopodobieństwo zakażenia podczas przenoszenia roztworów do naczynia.
Regulator przepływu gazu

MASSFLOW LAMBDA jest nowym kontrolerem systemu przepływu mas specjalnie zaprojektowanym do użytku wraz z bioreaktorami i fermentatorami laboratoryjnymi LAMBDA. Umożliwia on kontrolę pH hodowli komórkowej przez kontrolowane dodawanie gazowego CO2, kontrolę azotu lub innego gazu z odpowiedniego regulatora. Jednakże, może być również stosowany zupełnie niezależnie, ponieważ wszystkie funkcje mogą być dostępne z przedniego panelu MASSFLOW.
Wysokiej jakości laminarny czujnik przepływu mierzy szybkość przepływu. Wynik pojawia się na wyświetlaczu cyfrowym. Regulator przepływu ma bardzo niski spadek ciśnienia i liniowy błąd jest niższy niż ± 3 % odczytu. Powtarzalność jest lepsza niż ± 0,5 % odczytu. Szybkość przepływu jest regulowana przez specjalny zastrzeżony zawór igłowy kontrolowany przez mikroprocesor. Szybkość przepływu może być zaprogramowana, a objętości sumowane. MASSFLOW umożliwia precyzyjną, automatyczną kontrolę pH w kulturach komórkowych, bez potrzeby użycia jakiejkolwiek innej stacji gazowej.
Fermentacja ciągła (chemostat)
Skala adaptera (opcjonalnie) pozwala na ważenie fermentatora. Jest on umieszczony pod przednią częścią korpusu fermentatora i połączony z wejściem X w fermentorze. Przy pomocy pompy połączonej z gniazdem „Pomp X” w fermentatorze waga (objętość) kultury mogą być utrzymywane na stałym poziomie. Ta funkcja jest już zawarta w zestawie startowym. Pozwala to na ciągły bieg hodowli przy utrzymaniu niskich kosztów.
Program PC
FNet został specjalnie opracowany w celu monitorowania i kontroli procesów fermentacyjnych i kultur komórkowych w fermentatorze LAMBDA MINIFOR. Oprogramowanie działa w systemach Windows NT, 2000, XP, Vista, Windows 7, 8 i 10:
- Łatwy w instalacji i obsłudze
- Nie ma potrzeby znajomości oprogramowania
- Rozpoznaje podłączenie kadzi fermentacyjnych przy rozruchu
- Do 6 fermentatorów, 12 integratorów i 6 pomp na jednym komputerze
- Wszystkie kable wykorzystują standardowe złącza
Dla bardzo wysokich wymagań, proponujemy oprogramowanie fermentacji SIAM. Prawie nie występują wymaganie, które nie mogą zostać spełnione z SIAM. Funkcje mogą być dodawane zgodnie z potrzebami użytkownika.
Parametry techniczne
Fermentator/bioreaktor LAMBDA MINIFOR jest kontrolowany przez dwa mikroprocesory.
Zasilanie: sieciowe 100–240 V AC / 50–60 Hz, 510 W, zgodne z CE
Wymiary: 22 × 40 × 38cm (W × D × H)
Wyświetlacz: LCD 4×40 znaków z podświetleniem
Naczynie fermentacyjne: szkło Pyrex z 6 do 8 bocznymi szyjami: 0,3; 0,4; 1; 3 i 7 l
Pojemność robocza: 35 ml do ponad 6 litrów
Regulacja temperatury: źródło promieniowania cieplnego IR z pozłacanym reflektorem 150 W
Regulacja: od 5 °C powyżej temperatury pokojowej do ponad 70 °C
Pomiar: od 0 do 99,9 °C w 0,1 °C odstępach
Dokładność: ± 0,2 °C (0 do 60 °C)
Czujnik: PT 100 połączony z czujnikiem pH
Kontrola pH: sterylizowalna elektroda pH (Mettler), pH 0-13, z automatyczną korekcją temperatury, złącze VarioPin, półautomatyczna dwupunktowa kalibracja
Rozdzielczość: 0,01 jednostki pH
Dokładność: ± 0,02 jednostki pH
Pompy: do 4 niezależnych pomp perystaltycznych (PRECIFLOW, MULTIFLOW, HIFLOW lub MAXIFLOW) ze zmienną prędkością od 0 do 100 % może być stosowanych z MINIFOR
Kontrola pO2: sterylizowany czujnik tlenu typu Clark, korpus PEEK, membrana Mettler, automatyczna korekcja temperatury
Zakres: od 0 do 25 mg tlenu/l, w 0,1 mg/l odstępach, automatyczne sterowanie poprzez regulację przepływu powietrza
Przepływ powietrza: od 0 do 5 l min. w 0,01 l/min. odstępach, miernik przepływu, liniowość ± 3 %,
Powtarzalność: ± 0,5 %
Kontrola: zawór proporcjonalny
Dla dostarczonego ciśnienia powietrza: pomiędzy 0,05–0,2 MPa (max.)
Mieszanie: 50 W mieszadło wibracyjne 0 do 20 Hz (0 do 1200 obrotów na minutę), w 0,1 Hz odstępach, 1 lub więcej dysków mieszających
Parametry do wyboru: dodatkowy parametr może być kontrolowany przez urządzenie (kontrola pienienia, pCO2, gęstość optyczna, przewodność, itp.)
Pobieranie prób/dodawanie portów: do 4 igieł ze stali nierdzewnej z podwójnym uszczelnieniem LAMBDA PEEK może być wykorzystywanych do pobierania próbek i dodawania roztworów korygujących
Temperatura pracy: 0–40 °C
Wilgotność względna pracy: 0–90% RH (bez kondensacji)
Bezpieczeństwo: zgodne z normą IEC 1010/1
Waga: 7,5 kg
Kontrola PC: pełna kontrola PC i obróbka danych za pomocą FNet lub oprogramowania SIAM (opcjonalnie)
Gwarancja: 2 lata
Wymiary: 22 x 40 x 38 cm (W x D x H)
Wyświetlacz: LCD 4 x 40 digits with backlight illumination
Naczynie fermentacyjne: Pyrex glass with 6 to 8 side necks; 0.3, 0.4, 1, 3, 7 liter vessels
Regulacja temperatury: High efficiency 150 W infrared (IR) radiation heat source with gilded parabolic reflector
Regulacja: from 5°C over RT to 70°C
Pomiar: from 0 to 99.9°C in 0.1°C steps
Dokładność: +/- 0.2°C (0 to 60°C)
Czujnik: Pt 100 incorporated in the glass electrode of the pH probe
Kontrola pH: sterilisable pH electrode pH 0-14 with automatic temperature correction, two-point semiautomatic calibration and Variopin connector
Rozdzielczość: 0.01 pH unit
Dokładność: +/- 0.02 pH unit
Kontrola pO2: sterilisable Clark type oxygen sensor with fast response, automatic temperature correction, two-point semiautomatic calibration, dissolved oxygen (DO) control through regulation of the airflow rate
Zakres: 0 to 25 mg oxygen/ l, in 0.1 mg/l steps
Przepływ powietrza: 0 to 5 l/min in 0.01 l/min steps, measured by precise mass flow meter, linearity +/- 3%, reproducibility +/- 0.5%
Kontrola: proportional valve controlled by microprocessor
Dla dostarczonego ciśnienia powietrza: 0.05 – 0.2 MPa (0.5 - 2 atm)
Mieszanie: 50 W Vibromixer 0 to 20 Hz (0 to 1200 rpm) in 0.1 Hz steps (6 rpm) with 1 or more stirring discs; Sterility similar to magnetic coupling
Parametry do wyboru: an additional parameter can be controlled by the instrument (foaming control, weight (for continuous cultures), pCO2, redox potential, conductivity, optical density, etc.); with standard 0-10V or 0-20mA output
Pobieranie prób/dodawanie portów: One large quadruple sampling or additions port with four needles with LAMBDA PEEK double-seal connections, used for sampling, inoculation, antifoam, feeds, harvest, addition of correction solutions etc., additional double ports are available.
Pompy: up to 4 independent pumps (PRECIFLOW, MULTIFLOW, HIFLOW or MAXIFLOW) with speed variation from 0 to 100 % can be used with MINIFOR lab fermenter-bioreactor
Gas flow control: In addition to pumps, several electronic flow controllers with flow rate ranges of 0-5 l/min (MASSFLOW 5000) or 0-500 ml/min (MASSFLOW 500) can be used for the controlled addition of gases (e.g. N2, O2, air, CO2) in cell cultures; freely configurable gas station module
Temperatura pracy: 0 – 40 °C
Wilgotność względna pracy: 0 - 90 % RH, not condensing
Waga: 7.5 kg
Kontrola PC: complete PC control and data processing using the fermentation software FNet (for up to 6 MINIFOR fermenters) or SIAM (for an even higher number of instruments)
- EN - LAMBDA MINIFOR Laboratory Fermenter-Bioreactor LEAFLET (pdf)
- EN - 20 innovations of LAMBDA MINIFOR laboratory-scale bioreactors — Overview and Benefits (pdf)
- EN - LAMBDA MINIFOR laboratory fermenter and bench-top bioreactor at universities and highschools (pdf)
- EN - Operation manual: MINIFOR lab fermentor-bioreactor (pdf)
- EN - Infographics: Overview of innovations in MINIFOR lab fermenter and bioreactor (pdf)
- EN - Quick overview of MINIFOR bioreactor vessels with connections, probes & tubing lines (pdf)
- EN - Peltier electronic cooling loop for Minifor fermentor (pdf)
- EN - PUMP-FLOW INTEGRATOR replaces the need for optical density measurements in fermenters and bioreactors (pdf)
- EN - REDOX potential measurement for MINIFOR laboratory fermentor (pdf)
- EN - MINI-4-GAS, the automatic gas mixing module (pdf)
- EN - How to compare the cost and real value of a laboratory fermentor? (pdf)
- EN - Solitary teamplayer in parallel processes - LAMBDA MINIFOR laboratory fermenter and bioreactor (pdf)
- DE - UNI _ LAMBDA MINIFOR Laborfermenter und Tischbioreaktor an Hochschulen (pdf)
- DE - Montageanleitung _ Kurzübersicht der Bioreaktorgefässe LAMBDA MINIFOR mit Anschlüssen, Sonden und Schlauchlinien (pdf)
- DE - Broschüre _ MINIFOR Laborfermenter Bioreaktor (pdf)
- DE - Parallelreaktor _ LAMBDA MINIFOR Laborfermenter Bioreaktor der Einzelgänger im Parallelsystem (pdf)
- DE - Bedienungsanleitung _ LAMBDA MINIFOR Labor-Tischfermenter und Bioreaktor (pdf)
- DE - LAMBDA MINIFOR Laborfermenter und Bioreaktor - Innovationsuebersicht und Vorteile (pdf)
- FR - MINIFOR - fermenteur de laboratoire (pdf)
- FR - Installation de cuve LAMBDA MINIFOR (pdf)
- FR - LAMBDA MINIFOR Start-Up Kit - mode d'emploie (pdf)
- FR - LAMBDA MINIFOR fermenteur / bioreacteur - Resume des innovations et avantages (pdf)
- FR - LAMBDA MINIFOR fermenteur de laboratoire-bioréacteur de paillasse et son utilisation dans les écoles et universités (pdf)
- FR - Le fermenteur et bioréacteur de laboratoire MINIFOR: Le joueur solitaire dans l’équipe des procédés en parallèle (pdf)
- FR - Comment comparer le coût d’un fermenteur ou bioréacteur avec sa valeur réelle ? (pdf)
- RU - Лабораторный ферменторбиореактор ЛАМБДА МИНИФОР (pdf)
- CZ - MINIFOR - laboratorní fermentor (pdf)
- ES - Manual de operaciones - LAMBDA MINIFOR Fermentador-Biorreactor de Laboratorio (pdf)
- ES - LAMBDA MINIFOR Biorreactor-fermentador de laboratorio - resumen de innovaciones y ventajas (pdf)
- ES - Fermentador-biorreactor de laboratorio LAMBDA MINIFOR para las escuelas y universidades (pdf)
- ES - MINIFOR - fermentador de laboratorio (pdf)
- ES - Fermentador y biorreactor LAMBDA MINIFOR: El solitario en procesos paralelos (pdf)
- ES - ¿Cómo comparar el coste y el valor real de un fermentador y biorreactor de laboratorio? (pdf)
The mouse hybridoma producing the CB.Hep-1 monoclonal antibody (mAb) was cultivated for 100 days in protein-free medium using a Lambda MINIFOR bioreactor. The Lambda MINIFOR bioreactor robustness is adequate for long-term production of mammalian cells at bench-scale. The work was aimed to demonstrate the stability of CB.Hep-1 hybridoma cells cultivated in the Lambda MINIFOR bioreactor operated under continuous mode and supplemented with PFM, for 100 days..
González M, Aragón H, Medel M, Hernández D, Ferro W, Llamo A, et al. Continuous culture of mouse hybridoma cells for 100 Days in the Lambda MINIFOR bioreactor. Biotecnol Apl. 2024;41(2):2211-8.
2025
An in vitro dynamic biofilm model was established using a Lambda Minifor bioreactor (LAMBDA Laboratory Instruments, Baar, Switzerland). The system utilized a sterile modified BHI medium, delivered via a peristaltic pump at constant pressure, to maintain bacterial inoculum under controlled oral-like conditions (37 °C, pH 7.2, anaerobic).
Nuevo, P., Virto, L., Ribeiro-Vidal, H., Gil, J., & Sanz, M. (2025). In vitro assessment of a novel piranha-passivated dental implant surface against oral biofilm formation. Clinical Oral Implants Research, 1–11. https://doi.org/10.1111/clr.70031
Two Lambda Minifor fermenters (1 L, LAMBDA Instruments GmbH, Baar, Switzerland) were used in continuous MCF. Equipped with pH-temperature electrodes, an IR heater, a weighing module, and peristaltic pumps for base, acid, feed, and effluent, the fermenters were maintained at 30 °C with a 4-day HRT. The weighing module controlled effluent to keep constant volume.
Brodowski, F., Gutowska, N., Duber, A., Zagrodnik, R., Łężyk, M., & Oleskowicz-Popiel, P. (2025). Microbial and metabolic variations in pH-dependent chain elongation: Co-utilization of lactate and ethanol vs. lactate-based production. Chemical Engineering Journal, 519, 165367. https://doi.org/10.1016/j.cej.2025.165367
The fermentations were carried out in a 3 L biofermentor (LAMBDA MINIFOR, LAMBDA Laboratory Instruments, Baar, Switzerland) with a 2 L working volume, and samples were taken every 8 h. Optical density, sugar concentration, and lactic acid content were monitored.
Mabia, A. G., Andrianisa, H. A., Danielli, C., Ouattara, L. Y., Kouadio, N. E., Kouassi, E. K. A., Gardossi, L., & Yao, K. B. (2025). Exploring the Synthesis of Lactic Acid from Sugarcane Molasses Collected in Côte d’Ivoire Using Limosilactobacillus fermentum ATCC 9338 in a Batch Fermentation Process. Bioengineering, 12(8), 817. https://doi.org/10.3390/bioengineering12080817
Co-culturing & Anaerobic fermentation: The mixed inoculum was introduced into the reaction chamber of the Lambda Minifor bioreactor (LAMBDA Laboratory Instruments, Sihlbruggstrasse, Switzerland), which was maintained at 37°C under anaerobic conditions. Planktonic growth within the bioreactor was allowed for 12 hours, after which the culture was maintained in continuous operation with a flow rate of 30 mL/h using a peristaltic pump..
Khan, S. N., Ribeiro-Vidal, H., Virto, L., Bravo, E., Nuevo, P., Koldsland, O. C., Hjortsjö, C., & Sanz, M. (2025). The decontamination effect of an oscillating chitosan brush compared with an ultrasonic PEEK-tip: An in vitro study using a dynamic biofilm model. Clinical Oral Implants Research, 36(1), 73–81. https://doi.org/10.1111/clr.14360
Biocatalytic research: The study focuses on optimizing the second step of a biocatalytic process for producing 2-GLVs using soybean 13-lipoxygenase in a controlled laboratory fermenter (Lambda Minifor), highlighting parameters such as temperature, reaction time, oxygen flow, enzyme load, and substrate concentration.
Faillace, E., Brunini-Bronzini de Caraffa, V., Gambotti, C., Berti, L., Maury, J., & Vincenti, S. (2025). Optimizing the second step of the biocatalytic process for green leaf volatiles production: Synthesis by soybean 13-lipoxygenase of 13-hydroperoxides from hydrolyzed hempseed oil. Biocatalysis and Agricultural Biotechnology, 65, Article 103548. https://doi.org/10.1016/j.bcab.2025.103548
LAMBDA MINIFOR bioreactor was used to perform submerged fermentation of cocoa pod husks (Theobroma cacao L.) for lactic acid production using Lactobacillus fermentum ATCC 9338.
The system enabled precise control of pH, temperature, agitation, and aeration throughout the fermentation process.
Ouattara, L. Y., Konan, A. T. S., Mahamane Nassirou, A. K., Sanou, A., Mabia, A. G., Appiah Kouassi, E. K., Soro, D., Yao, K. B., Drogui, A. P., & Tyagi, D. R. (2025). Use of cocoa pods husks (Theobroma cacao L.) as a potential substrate for the production of lactic acid by submerged fermentation using Lactobacillus fermentum ATCC 9338. Waste and Biomass Valorization. https://doi.org/10.1007/s12649-025-03010-y
Small-scale batch fermentations of L. coryniformis: We used a Lambda Minifor bioreactor system with 35–400-mL working capacity vessels. The working volume was 300 mL. The fermentations were maintained at 30°C, stirring 0.5 Hz, CO2 flow of 0.04 L/min, and pH 6.5 for 72 h... Bioreactor fermentations were conducted in five independent replicates F1–F5.
Elvan Gezer M, Gravlund Fønss K, Bambace MF, Marietou A, Sandberg Overby S, Sundekilde U, Schwab C.2025.Investigation on L-rhamnose metabolism of Loigolactobacillus coryniformis subsp. coryniformis DSM 20001 and its propionate-containing fermentates. Appl Environ Microbiol91:e01613-24. https://doi.org/10.1128/aem.01613-24
2024
Simultaneous Saccharification and Fermentation (SSF): The LAMBDA MINIFOR bioreactor was used for both the fermentation of pretreated solid biomass (10 %) in the presence of cellulase, β-glucosidase and inoculated with Lactobacillus rhamnosus (1.7 L, 37 °C, pH=5.5, 72 h), as well as for the subsequent fermentation of hydrolysates with Bacillus megaterium (1.7 L, 35 °C, 48 h).
Senila, L., Kovacs, E., Resz, M. A., Senila, M., Becze, A., & Roman, C. (2024). Life Cycle Assessment (LCA) of Bioplastics Production from Lignocellulosic Waste (Study Case: PLA and PHB). Polymers 2024, 16, 3330.
https://doi.org/10.3390/polym16233330
Anaerobic batch cultivation of C. butyricum in a LAMBDA MINIFOR 3L fermenter, flushed with argon prior to fermentation: pH 5.6 (controlled with 1M NaOH), 37°C and 6000 rpm. Gas production was measured by the water displacement method, displaced water volume monitored by a camera. Liquid and gas samples were collected at intervals.
Pištěková, H., Dusankova, M., Sopik, T., Klaban, J., Dostalkova, J., Moučka, R., & Sedlarik, V. Optimization of the Dark Fermentation Technique for Hydrogen Production Through Supplementation with Ascorbic Acid And/Or L-Cysteine by Clostridium Butyricum Ccdbc 11. Or L-Cysteine by Clostridium Butyricum Ccdbc, 11.
https://dx.doi.org/10.2139/ssrn.4973469
Alcoholic fermentations tested under microvinification conditions and in a LAMBDA MINIFOR bioreactor with controlled parameters (T = 20 °C, agitation frequency = 2 Hz) and standard conditions (T = 12 - 14 °C).
Filimon, G. (2024). Monitorizarea fermentaţiei alcoolice a musturilor obţinute din soiuri de struguri rizogene. Universitatea Tehnică a Moldovei. Technical Scientific Conference of Undergraduate, Master and PhD Students: Chişinău, 27-29 martie 2024. Vol. 2.
URI: http://repository.utm.md/handle/5014/28059
Biodegradation: Treatment of marine samples with the addition of “Diesel-B5” (10 %, 15 %, 20 %) as a C-source in aerated and stirred LAMBDA MINIFOR bioreactors (Pseudomonas sp.; pH 6.5; incubation temperatures 25 °C, 35 °C and 45 °C).
Peña Ventura, J. C. (2024). Determinación del ratio de biodegradación de hidrocarburos totales de petróleo empleando Pseudomonas sp. en agua de mar contaminada con diésel-B5. Universidad Nacional de Trujillo, Unidad de Postgrado en Ingeniería Química, Tesis de maestro en ingeniería química ambiental.
URI: https://hdl.handle.net/20.500.14414/22166
"The mixed inoculum was inoculated into the reaction chamber of the LAMBDA MINIFOR bioreactor, which was maintained at 37 °C under anaerobic conditions."
Khan, S. N., Ribeiro‐Vidal, H., Virto, L., Bravo, E., Nuevo, P., Koldsland, O. C., Hjortsjö, C. & Sanz, M. (2024). The Decontamination Effect of an Oscillating Chitosan Brush Compared With an Ultrasonic PEEK‐Tip: An In Vitro Study Using a Dynamic Biofilm Model. Clinical Oral Implants Research.
https://doi.org/10.1111/clr.14360
The batch co-culture fermentation of date palm syrup with S. cerevisiae and P. stipitis ATCC 58785 was carried out in a LAMBDA MINIFOR 1L Advanced Kit stirred tank fermenter.
Shalsh, F. J., Gatte, E. H., Alsultan, I. I., Tariq, F. Z., Jassim, S. M., Saleh, M. T., & Alrazzaq, N. A. (2024). Bioplastic Compounds of Succinic Acid from Agriculture Waste; Date Palm Syrup And Date Palm Fronds. Nepal Journal of Biotechnology, 12(1), 32-39.
https://doi.org/10.54796/njb.v12i1.310
In vitro development of a dynamic multispecies biofilm model on implant surfaces: Planktonic growth of a mixture of six different bacterial strains inside the LAMBDA MINIFOR bioreactor (12 h), followed by continuous culture (flow rate of 30 mL/h) through 2 Robbins devices containing the sterile implants (37 °C, anaerobic, 72 h).
Khan, S. (2024). Efficacy of Mechanical Decontamination Strategies in the Treatment of Peri-implantitis. Doctoral thesis, University of Oslo.
URI: https://hdl.handle.net/10852/111365 (2024 August 07)
In vitro dynamic multispecies biofilm model: During the entire incubation process (biofilms growing on implant surfaces), the LAMBDA MINIFOR bioreactor maintains the culture medium at 37 °C, pH 7.2 and an anaerobic atmosphere (10% H2, 10% CO2 and N2 balance).
Bravo, E., Arce, M., Ribeiro-Vidal, H., Herrera, D., & Sanz, M. (2024). The Impact of Candida albicans in the Development, Kinetics, Structure, and Cell Viability of Biofilms on Implant Surfaces—An In Vitro Study with a Validated Multispecies Biofilm Model. International Journal of Molecular Sciences, 25(6), 3277.
https://doi.org/10.3390/ijms25063277
Submerged batch (consortia) and fed-batch (L. coryniformis) fermentations in LAMBDA MINIFOR stirred-tank bioreactor and SIAM software: 72 h, final working volumes = 200 ml, T = 37 ± 0.5 °C, stirring 0.5 Hz, sparing CO2 at 0.04 L/min, pH 6.5 ± 0.5 using 1 M NaOH and 1 M H2SO4 for automatic pH adjustment; samples were taken in regular intervals.
Buljubašić, E., Bambace, M. F., Christensen, M. H. L., Ng, K. S., Huertas‐Díaz, L., Sundekilde, U., Marietou, A. & Schwab, C. (2024). Novel Lactobacillaceae strains and consortia to produce propionate‐containing fermentates as biopreservatives. Microbial Biotechnology, 17(2), e14392.
https://doi.org/10.1111/1751-7915.14392
The in vitro multispecies dynamic biofilm model was used which has been validated on biofilms growing on implant surfaces: LAMBDA MINIFOR bioreactor maintains the protein-enriched BHI medium under stable conditions: 37 °C, pH 7.2 and an anaerobic atmosphere by directly pumping an anaerobic gas mixture (10% H2, 10% CO2 and equilibrium N2) keeping the pressure constant during the whole incubation process
Bravo, E., Arce, M., Ribeiro-Vidal, H., Herrera, D., & Sanz, M. (2024). The Impact of Candida albicans in the Development, Kinetics, Structure, and Cell Viability of Biofilms on Implant Surfaces. An In Vitro Study with a Validated Multispecies Biofilm Model.
https://doi.org/10.20944/preprints202402.1137.v1
Simulated human colon model LAMBDA MINIFOR with basal nutrient medium (37 °C, pH 6.8) and faecal slurries
Pusuntisumpun, N., Tunsagool, P., Nitisinprasert, S., & Nakphaichit, M. (2024). Impacts of combining Limosilactobacillus reuteri KUB‐AC5 and Limosilactobacillus fermentum KUB‐D18 on overweight gut microbiota using a simulated human colon model. International Journal of Food Science & Technology.
https://doi.org/10.1111/ijfs.16941
400 ml isolated tomato cells in a LAMBDA MINIFOR bioreactor (20 °C, pH 5.8) got sparged (10 L/h) to achieve varied O2 concentrations (21 kPa, 5 kPa, and 0 kPa) for the study of postharvest losses of fruits and vegetable during controlled atmosphere storage as a result of low O2 stress.
Mahomud, M. S., Islam, M., & Roy, J. (2024). Effect of low oxygen stress on the metabolic responses of tomato fruit cells. Heliyon, e24566.
https://doi.org/10.1016/j.heliyon.2024.e24566
Hülber-Beyer, É. A., Nemestóthy, N., & Bélafi-Bakó, K. (2023). Case Study of Continuous Itaconic Acid Fermentation by Aspergillus Terreus in a Bench-Scale Bioreactor. Hungarian Journal of Industry and Chemistry, 51(2), 57-63.
Pictures of morphology during fermentation: Fig. 1 on https://hjic.mk.uni-pannon.hu/index.php/hjic/article/view/1214/1092 (2024 Feb. 08)
Senila, L., Cadar, O., Kovacs, E., Gal, E., Dan, M., Stupar, Z., Simedru, D., Senila, M. & Roman, C. (2023). L-Poly(lactic acid) Production by Microwave Irradiation of Lactic Acid Obtained from Lignocellulosic Wastes. Int. J. Mol. Sci. 2023, 24, 9817.
Senila, L., Gál, E., Kovacs, E., Cadar, O., Dan, M., Senila, M. & Roman, C. (2023). Poly(3-hydroxybutyrate) Production from Lignocellulosic Wastes Using Bacillus megaterium ATCC 14581. Polymers. 2023, 15, 4488.
Bravo, E., Serrano, B., Ribeiro-Vidal, H., Virto, L., Sánchez, I.S., Herrera, D. & Sanz, M. (2023). Biofilm formation on dental implants with a hybrid surface microtopography: An in vitro study in a validated multispecies dynamic biofilm model. John Wiley & Sons, Ltd., 0905-7161. Clinical Oral Implants Research, Volume 34, Issue 5, May 2023 Pages i-iii, 405-541.
Simulation of in-vitro gut model with LAMBDA MINIFOR 0.3L: Batch fermentations under anaerobic conditions (37 °C, pH 6.8–6.9, 24 h) of human fecal slurry (1% (v/v)) to evaluate the effect of Triphala extracts (1 mg/mL) co-fermentation on microbiota and metabolic changes.
Kwandee, P., Somnuk, S., Wanikorn, B., Nakphaichit, M. & Tunsagool, P. (2023). Efficacy of Triphala extracts on the changes of obese fecal microbiome and metabolome in the human gut model. Journal of Traditional and Complementary Medicine, Volume 13, Issue 2, 2023, Pages 207-217, ISSN 2225-4110.
Gastrointestinal Simulation Model SHIME with LAMBDA MINIFOR 0.3L reactors:
Each Simulator of Human Intestinal Microbial Ecosystem consists of five reactors, mimicking different sections of the human Gastrointestinal tract.
The video https://www.youtube.com/watch?v=hXcpa0bXu6Q shows Assoc. Prof. Massalin Nakphaichit in front of the SHIME reactors.
Department of Biotechnology, Faculty of Agro-Industry, Kasetsart University
In a bench-scale LAMBDA MINIFOR 7L bioreactor with programmable probes, RODMs (a set of organisms with novel metabolism, efficiently degrading highly-concentrated aromatics) were developed for a high-density microbial ecosystem.
Ahmad, M., Yousaf, M., Han, J.-C., Huang, Y., Zhou, Y. & Tang, Z. (2023). Development of Biocatalytic Microbial Ecosystem (FPUS@RODMs@In-PAOREs) for Rapid and Sustainable Degradation of Various Refractory Organics. Journal of Hazardous Materials, 2023, 131514, ISSN 0304-3894,
https://doi.org/10.1016/j.jhazmat.2023.131514
Hybridoma cell (inoculation 4.0×10E5 cells/mL (90% viability)): Fed-batch in a LAMBDA MINIFOR stirred-tank bioreactor.
Llamo, A., Hernández, D., García, C., González, M., Ferro, W., Garay, H., Diago, D., Fajardo, A., Espinosa, L., Padilla, S., Gómez, L., Chinea, G. & and Valdés, R. (2023). Gamma-Immunoglobulin Response Characterization, in COVID-19 Convalescent Patients, Against the Spike Protein S2 Subunit with Eight Linear Peptides for Monoclonal Antibody Generation. BioProcess J, 2023; 22.
https://doi.org/10.12665/J22OA.Llamo
Optimization of lipase-catalyzed hydrolysis of vegetable oils: Control and monitoring by a LAMBDA MINIFOR bioreactor (pH, temperature, reaction time, enzyme load and oil/aqueous ratio of the reaction mixture).Faillace, E., Brunini-Bronzini de Caraffa, V., Mariani, M., Berti, L., Maury, J. & Vincenti, S. (2023). Optimizing the First Step of the Biocatalytic Process for Green Leaf Volatiles Production: Lipase-Catalyzed Hydrolysis of Three Vegetable Oils. International Journal of Molecular Sciences. 2023; 24(15):12274.
https://doi.org/10.3390/ijms241512274
Evaluation of viability and maximum specific growth rate of Bacillus licheniformis in a bench-top LAMBDA MINIFOR 7L laboratory bioreactor (2 litres working volume, 37 °C, pH 6.5, 200 rpm, controlled oxygen, submerged batch fermentation (SMF), addition of sterilized Antifoam 204 agent (Sigma-Aldrich))
Dumitru, M. & Ciurescu, G. (2023). Optimization of the fermentation conditions and survival of Bacillus licheniformis as freeze-dried powder for animal probiotic applications. Scientific Papers. Series D. Animal Science. Vol. LXVI, No. 2, 2023; ISSN 2285-5750; ISSN CD-ROM 2285-5769; ISSN Online 2393-2260; ISSN-L 2285-5750. https://www.animalsciencejournal.usamv.ro/pdf/2023/issue_2/Art10.pdf (2024 Jan. 02)
Alonso-Español, A., Bravo, E., Ribeiro-Vidal, H., Virto, L., Herrera, D., Alonso, B. & Sanz, M. (2023). The Antimicrobial Activity of Curcumin and Xanthohumol on Bacterial Biofilms Developed over Dental Implant Surfaces. Int. J. Mol. Sci. 2023, 24, 2335.
Milk was pasteurized at 70 °C for 30 min in LAMBDA MINIFOR fermenters
LAMBDA MINIFOR fermenters: Temperature effect tests on growth of yeast Kazachstania unispora (initial ~10E6 CFU/ml) in milk (800 ml, ~6 % lactose): from 5 °C to 40 °C (5, 10, 15, 20, 25, 27, 30, 32, 35, 37, and 40 °C) at pH 5.6 (automatic adjustment with 2 M NaOH) and 240 rpm, until stationary phase was reached (inline near-infrared turbidity sensor Optek FC20- ASD10-N)
LAMBDA MINIFOR fermenters for coculture experiments at 25 °C of Lacticaseibacillus casei and Kazachstania unispora in modfied MRS media as well as in mare milk (initial: ~10E6 CFU/ml, pH = 6.8)
LAMBDA MINIFOR fermenters for coculture experiments at 30 °C of Lactobacillus kefiri and Kazachstania unispora in modfied MRS media as well as in mare milk (initial: ~10E6 CFU/ml, pH = 6.8)
Kondybayev, A., Achir, N., Mestres, C., Collombel, I., Strub, C., Grabulos, J., Akhmetsadykov, N., Aubakirova, A., Kamidinkyzy, U., Ghanmi, W. & Konuspayeva, G. (2023). Growth Kinetics of Kazachstania unispora and Its Interaction with Lactic Acid Bacteria during Qymyz Production. Fermentation 2023, 9, 101.
https://doi.org/10.3390/fermentation9020101
Pasotti, L., De Marchi, D., Casanova, M., Frusteri Chiacchiera, A., Cusella De Angelis, M. G., Calvio, C., & Magni, P. (2023). Design of a stable ethanologenic bacterial strain without heterologous plasmids and antibiotic resistance genes for efficient ethanol production from concentrated dairy waste. Biotechnology for Biofuels and Bioproducts, 16(1), 1-13.
https://doi.org/10.1186/s12896-017-0369-y
2022:
www.geniusjournals.org/index.php/emrp/article/view/2162 (2022 Sept. 22)
LAMBDA MINIFOR bioreactor and fermentor for schooling & university
Lactic acid bacteria growth experiments: Effect of temperature on Lacticaseibacillus casei and Lactobacillus kefiri.
Kondybayev, A.; Konuspayeva, G.; Strub, C.; Loiseau, G.; Mestres, C.; Grabulos, J.; Manzano, M.; Akhmetsadykova, S. & Achir, N. (2022). Growth and Metabolism of Lacticaseibacillus casei and Lactobacillus kefiri Isolated from Qymyz, a Traditional Fermented Central Asian Beverage. Fermentation 2022, 8, 367.
During 65 days, two continuous (HRT= 5 days) stirrer tank fermenters LAMBDA MINIFOR were operated under anaerobic conditions (N2 into headspace & sparging), each with 1 liter working volume (modification of lactate / acetate concentrations) inoculated with caproate-producing sludge (Caproiciproducens genus (Ruminococcaceae family)), temperature control (30 °C, build-in IR heater, Mettler InPro 3253 probe) and pH control (pH 5.5, NaOH 2M, HCl 0.5M) ) with four peristaltic pumps (feed, effluent, base & acid) and daily liquid sampling for carboxylates and alcohols analysis.
Brodowski, F., Lezyk, M., Gutowska, N., Kabasakal, T. & Oleskowicz-Popiel, P. (2022). Influence of lactate to acetate ratio on biological production of medium chain carboxylates via open culture fermentation. Science of The Total Environment, Volume 851, Part 1, 2022, 158171, ISSN 0048-9697.
The continuous culture was performed in a Lambda Photobioreactor (PBR). White light from the LAMBDA LUMO module was calibrated to umolm−2 m−1. For evaporation control and continuous culture mode, the total weight of the reactor setup was kept constant using the built-in LAMBDA reactor mass control module and automatic addition of fresh culture medium through the feed pump. Continuous culture was performed by setting the waste pump to a fixed speed.
Behle, A., Dietsch, M., Goldschmidt, L., Murugathas, W., Berwanger, L.C., Burmester, J., Yao, L., Brandt, D., Busche, T., Kalinowski, J., Hudson, E.P., Ebenhöh, O., Axmann, I.M. & Machné, R. (2022). Manipulation of topoisomerase expression inhibits cell division but not growth and reveals a distinctive promoter structure in Synechocystis. Nucleic Acids Research, Volume 50, Issue 22, 9 December 2022, Pages 12790–12808.
https://doi.org/10.1093/nar/gkac1132
Biocatalytic resolution of lupanine racemate in industrial wastewater by Pseudomonas putida LPK411 using a lab‐scale bioreactor LAMBDA MINIFOR 0.4L under batch operation.
Parmaki, S., Esteves, T., Gonçalves, J.M.J. Catenacci, A., Malpei, F., Ferreira, F.C., Afonso C.A.M & Koutinas, M. (2022). Selective microbial resolution of lupanine racemate: Bioprocess development and the impact of carbon catabolite repression on industrial wastewater valorisation. Biomass Conv. Bioref. (2022).
https://doi.org/10.1007/s13399-022-03383-3
For releasing bioactive peptides, diluted Kiwicha protein isolate (KPI) from Amaranthus caudatus L. seed flour was subjected to enzymatic hydrolysis with Bioprotease LA-660 using a LAMBDA MINIFOR bioreactor for continuous stirring, pH- and temperature control (pH 8; 50 °C).
Martinez-Lopez, A., Rivero-Pino, F., Villanueva, A., Toscano, R., Grao-Cruces, E., Marquez-Paradas, E., Martin, M.E., Montserrat-de la Paz, S. & Millan-Linaresa, M.C. (2022). Kiwicha (Amaranthus caudatus L.) protein hydrolysates reduce intestinal inflammation by modulating the NLRP3 inflammasome pathway. Food & Function 2022 Oct 21.
https://doi.org/10.1039/D2FO02177C
Escherichia coli (E. coli; E44Δ) mutant strain for production of large quantity of outer membrane vesicles (OMVs) in a LAMBDA MINIFOR 7L fermenter.
Allahghadry, T., Bojesen, A.M., Whitehead, B.J. and Antenucci, F. (2022). Clarification of large-volume bacterial cultures using a centrifuge-free protocol. J Appl Microbiol. Accepted Author Manuscript.
https://doi.org/10.1111/jam.15608
2021:
Experiments on liquid phase (hemicelluloses hydrolysate) for xylitol production: The fermentation of 250 ml of detoxified hydrolysate was conducted in a 1L fermenter (LAMBDA MINIFOR bench-top-laboratory-fermenter) and pH adjustment (pH 5.0) at aerobic conditions at 30 °C for 60 hr.
Shalsh, D., Nagimm, D., Alrheem, M.A. & Alrheem, S.A. (2021). Batch fermentation and Simultaneous Saccharification and Fermentation (SSF) processes by Meyerozyma Guilliermondii Strain F22 and Saccharomyces cerecvisae for xylitol and bioethanol co-production. Al-Qadisiyah Journal of Pure Science, 26(4), 80–94.
https://doi.org/10.29350/qjps.2021.26.4.1347
The growth, glucose consumption and ethanol production of Saccharomyces cerevisiae LM strain in synthetic broth were modeled for the most important intrinsic...One liter Lambda Minifor fermenters equipped with a cold water condenser on air exit pipes (LAMBDA Instruments GmbH, Baar- Switzerland), were used.
Kouamé, C., Loiseau, G., Grabulos, J., Boulanger, R. & Mestres, C. (2021). Development of a model for the alcoholic fermentation of cocoa beans by a Saccharomyces cerevisiae strain. International Journal of Food Microbiology, Volume 337, 2021, 108917, ISSN 0168-1605.
https://doi.org/10.1016/j.ijfoodmicro.2020.108917
Continuous culture of cyanobacteria Synechocystis sp. PCC 6803 in a LAMBDA MINIFOR 1L PBR photo-bioreactor.
Behle, A., Dietsch, M., Goldschmidt, L., Murugathas, W., Brandt, D., Busche, T., Kalinowski, J., Ebenhöh, O., Axmann, I. M. & Machné, R. (2021) Uncoupling of the Diurnal Growth Program by Artificial Genome Relaxation in Synechocystis sp. PCC 6803. bioRxiv 2021.07.26.453758.
https://doi.org/10.1101/2021.07.26.453758
The hydrolysis of kiwicha protein isolate (KPI) is performed under continuous stirring, using a LAMBDA MINIFOR fermenter-bioreactor, at controlled conditions of pH and temperature: Bioprotease LA-660 is added at a ratio enzyme/substrate = 0.3 AU/g protein (pH 8) for 5, 10, 15, 30, and 60 min.
Paz, S. M. D. L., Martinez-Lopez, A., Villanueva-Lazo, A., Pedroche, J., Millan, F., & Millan-Linares, M. C. (2021). Identification and characterization of novel antioxidant protein hydrolysates from kiwicha (Amaranthus caudatus L.). Antioxidants, 10(5), 645.
https://doi.org/10.3390/antiox10050645
The biological transformation of white sorghum biomass was performed under operating conditions similar to the MixAlco process. MixAlco batch fermentation process were performed in the LAMBDA MINIFOR bioreactor.
Shalsh, F.J., Alrazzaq, N.A., Nagimm D.K., Alrheem, M.A., Alrheem S.A. & Abd-alalah, K. (2021). Bioconversion of white sorghum biomass using MixAlco fermentation process. DYSONA – Applied Science. 2021(2), 21-27. ISSN 2708-6283.
https://doi.org/10.30493/DAS.2021.248966
2020:
Different yeast strains were cultivated in the LAMBDA MINIFOR 0.4L Fermentor to study the metabolic cylce and pathway.
J. Feltham, S. Xi, S. Murray, M. Wouters, J. Urdiain-Arraiza, C. George, A. Townley, E. Roberts, R. Fisher, S. Liberatori, S. Mohammed, B. Kessler & J. Mellor. (2020). Transcriptional changes are regulated by metabolic pathway dynamics but decoupled from protein levels. bioRxiv 833921.
https://doi.org/10.1101/833921
LAMBDA MINIFOR Bioreactor is used as a Rumen membrane bioreactor to produce volatile fatty acids (VFA) from crop residues (lignocellulosic biomass) by mimicking the digestive system of ruminant animals.
Nguyen, A.Q., Nguyen, L.N., Abu Hasan Johir, M., Ngo, H-H., Chaves, A.V. & Nghiem, L.D. (2020) Derivation of volatile fatty acid from crop residues digestion using a rumen membrane bioreactor: a feasibility study. Bioresource Technology 2020.
https://doi.org/10.1016/j.biortech.2020.123571
Enzymatic hydrolysis experiments were carried out in the lab-scale LAMBDA MINIFOR stirred-batch bioreactor. The pretreated vine-shoot waste was delignified with sodium chlorite for lignin removal and then enzymatically hydrolyzed using new types of enzymes (cellulase from Trichoderma reesei and b-glucosidase).
Eniko Kovacs, Daniela Alexandra Scurtu, Lacrimioara Senila, Oana Cadar, Diana Elena Dumitras & Cecilia Roman (2020). Green Protocols for the Isolation of Carbohydrates from Vineyard Vine-Shoot Waste. Analytical Letters.
https://doi.org/10.1080/00032719.2020.1721001
LAMBDA MINIFOR bioreactor used to produce Itaconic Acid biotechnologically by Aspergillus terreus fungal strain from glucose
Nemestóthy, N., Komáromy, P., Bakonyi, P. et al. (2020). Carbohydrate to Itaconic Acid Conversion by Aspergillus terreus and the Evaluation of Process Monitoring Based on the Measurement of CO2 Waste and Biomass. Valorization 2020.
https://doi.org/10.1007/s12649-019-00729-3
2019:
LAMBDA MINIFOR bioreactor used in turbidostat experiments with recombinant cells in continuous culture operation mode
Pasotti, L., Bellato, M., Politi, N., Casanova, M., ucca, S., Gabriella, M., De Angelis, C. & Magni, P. (2019). A synthetic close-loop controller circuit for the regulation of an extracellular molecule by engineered bacteria. IEEE Trans Biomed Circuits Syst. 2019 Feb; 13(1):248-258.
https://doi.org/10.1109/TBCAS.2018.2883350
pH optimization for the aerobical production of itaconic acid catalyzed by Aspergillus terreus in a LAMBDA MINIFOR bioreactor: Batch, working volume 1.8 L, medium with 120 g/L glucose substrate, 37 °C, pH 3 - pH 2.5 - pH 4 - pH 3 - pH 2.5, stirrer 2 Hz, aeration 1.5 L (STP)/min.
Komáromy, K., Bakonyi, P., Kucska, A., Tóth, G., Gubicza, L., Bélafi-Bakó, K. & Nemestóthy, N. (2019). Optimized pH and Its Control Strategy Lead to Enhanced Itaconic Acid Fermentation by Aspergillus terreus on Glucose Substrate. Fermentation 2019, 5(2), 31
https://doi.org/10.3390/fermentation5020031
Lab-Scale Production of Rhamnolipid by Pseudomonas Aeruginosa A3 using LAMBDA MINIFOR Benchtop Bioreactor.
Faqri, A. F., Hayder, N.H. & Hashim, A.J. (2019). Lab-scale production of Rhamnolipid by Pseudomonas Aeruginosa A3 and study its synergistic effect with certain antibiotics against some pathogenic bacteria. Iraqi Journal of Agricultural Sciences –2019:50(5):1290-1301.
https://doi.org/10.13140/RG.2.2.10802.35520
2018:
A large-scale pro-siRNA production method was developed in a LAMBDA MINIFOR bioreactor for high yield production of pro-siRNA
Kaur, G., Cheung, H. C., Xu, W., Wong, J. V., Chan, F. F., Li, Y., McReynolds, L. & Huang, L. (2018). Milligram scale production of potent recombinant small interfering RNAs in Escherichia coli. Biotechnology and Bioengineering, 115(9), 2280-2291.
https://doi.org/10.1002/bit.26740
LAMBDA MINIFOR lab scale bioreactor used for production of bioethanol from lignocellulosic biodegradable municipal solid waste (BMSW) under optimized conditions
Hayder, N. H., Flayeh, H. M., & Ahmed, A. W. (2018). Optimization of bioethanol production from biodegradable municipal solid waste using response surface methodology (RSM). Journal of Engineering and Sustainable Development, 22(1), 47-64.
https://www.iasj.net/iasj/download/28dcbea4ab5f5ba8 (2024 Feb. 05)
2017:
Comparison of the experimental and theoretical production of biogas. The LAMBDA MINIFOR bioreactor filled with 2 litres of inoculum was incubated anaerobically at 35 °C for 1 month.
El Asri, O., & Afilal, M. E. (2018). Comparison of the experimental and theoretical production of biogas by monosaccharides, disaccharides, and amino acids. International Journal of Environmental Science and Technology, 15(9), 1957-1966.
https://doi.org/10.1007/s13762-017-1570-1
Study of the metabolism of isolated lamb’s lettuce cells (Valerianella locusta (L). Laterr.) upon sugar starvation under O2 stress conditions using 13C [U-13C6] labelled glucose in a LAMBDA MINIFOR bench-top laboratory bioreactor (dark, 250 ml, pH 5.8, 18 °C, airation 10 L/h)
Victor, B. M. M., Ampofo-Asiama, J., Hertog, M., Geeraerd, A. H., & Nicolai, B. M. (2017). Metabolic profiling reveals a coordinated response of isolated lamb's (Valerianella locusta, L.) lettuce cells to sugar starvation and low oxygen stress. Postharvest Biology and Technology, 126, 23-33.
https://doi.org/10.1016/j.postharvbio.2016.12.004
LAMBDA MINIFOR fermenters used as continuous anaerobic flow stirred digesters (CSTR) for anaerobic digestion of organic solid waste
Nakasima-López, M., Taboada-González, P., Aguilar-Virgen, Q., & Velázquez-Limón, N. (2017). Adaptación de inóculos durante el arranque de la digestión anaerobia con residuos sólidos orgánicos. Información tecnológica, 28(1), 199-208.
https://dx.doi.org/10.4067/S0718-07642017000100020
The effect of different temperatures on sugar starvation in cells isolated from fresh leafy vegetables was studied in LAMBDA MINIFOR bioreactor
Mbong, V. B. M., Ampofo-Asiama, J., Hertog, M. L., Geeraerd, A. H., & Nicolai, B. M. (2017). The effect of temperature on the metabolic response of lamb’s lettuce (Valerianella locusta,(L), Laterr.) cells to sugar starvation. Postharvest Biology and Technology, 125, 1-12.
https://doi.org/10.1016/j.postharvbio.2016.10.013
LAMBDA MINIFOR bioreactor for the production of CB.Hep-1 mAb using mouse hybridoma cell culture in protein-free media
Valdés, R., Aragón, H., González, M., Hernández, D., Geada, D., Goitizolo, D., Ferro, W., Pérez, A., García, J., Masforrol, Y, Aguilar, P., Márquez, G., LaO, M., González, T., Calvo, Y., Hernández, A., Menéndez, G. & Tamayo, A. (2017). Mouse Hybridoma Cell Culture in a Protein-Free Medium Using a Bio-Mimicking Fish-Tail Disc Stirred Bioreactor. BioProcessing Journal, 16(1).
https://doi.org/10.12665/J161.Valdes
2016:
Robust cellulosic ethanol production from sugarcane bagasse with Saccharomyces cerevisiae ATCC 20602 in LAMBDA MINIFOR laboratory bioreactor under aerobic and anaerobic conditions with controlled redox potential measurement
Jabasingh, S. A., Lalith, D., Prabhu, M. A., Yimam, A., & Zewdu, T. (2016). Catalytic conversion of sugarcane bagasse to cellulosic ethanol: TiO2 coupled nanocellulose as an effective hydrolysis enhancer. Carbohydrate polymers, 136, 700-709.
https://doi.org/10.1016/j.carbpol.2015.09.098
2015:
Bioreactor system LAMBDA MINIFOR as an artificial mouth system for the growth of biofilms
LA BOCA ARTIFICIAL DE DENTAID UNA REVOLUCIÓN EN INVESTIGACIÓN BUCODENTAL
DENTAID EXPERTISE, PUBLICACIÓN PARA PROFESIONALES DE LA ODONTOLOGÍA, NÚM. 18.
https://aprenderly.com/doc/3463742/la-boca-artificial-de-dentaid-una-revolución-en-investiga…?page=5 (2024 Feb. 05)
S. pyogenes Cas9 protein was expressed in E. coli using a computer-controlled LAMBDA MINIFOR 3L bioreactor in batch mode followed by exponential feeding
Ménoret, S., De Cian, A., Tesson, L., Remy, S., Usal, C., Boulé, J. B., Boix, C., Fontanière, S., Crénéguy, A., Nguyen, T.H., Brusselle, L., Thinard, R., Gauguier, D., Concordet, J.-P., Cherifi, Y., Fraichard, A., Giovannangeli, C. & Anegon, I. (2015). Homology-directed repair in rodent zygotes using Cas9 and TALEN engineered proteins. Scientific reports, 5(1), 14410.
https://doi.org/10.1038/srep14410
Fermentation of engineered microorganism in laboratory scale bioreactor LAMBDA MINIFOR for efficient conversion of lactose-to-ethanol
Pasotti, L., Zucca, S., Casanova, M., Massaiu, I., Mazzini, G., Micoli, G., Calvio, C., Cusella de Angelis, M.G. & Magni, P. (2015, August). Methods for genetic optimization of biocatalysts for biofuel production from dairy waste through synthetic biology. In 2015 37th Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC) (pp. 953-956). IEEE.
https://doi.org/10.1109/EMBC.2015.7318521
Six-species flow cell biofilm model was developed by culturing bacteria in LAMBDA MINIFOR bioreactor to evaluate the biofilm development under flow and shear conditions
Salli, K. M., & Ouwehand, A. C. (2015). The use of in vitro model systems to study dental biofilms associated with caries: a short review. Journal of oral microbiology, 7(1), 26149.
https://doi.org/10.3402/jom.v7.26149
Quantification of ribosomal proteins (RPs) from Yeast cells cultured in LAMBDA MINIFOR bioreactor and mouse embryonic stem cells (ESC) to study the core RPs stoichiometry
Slavov, N., Semrau, S., Airoldi, E., Budnik, B., & van Oudenaarden, A. (2015). Differential stoichiometry among core ribosomal proteins. Cell reports, 13(5), 865-873.
https://doi.org/10.1016/j.celrep.2015.09.056
Harvard University, USA; Broad Institute of MIT and Harvard, USA and Hubrecht Institute, Netherlands.
2014:
Cultivation of microalgae (Chlorella vulgaris Beyerinck) in laboratory bioreactor LAMBDA MINIFOR
Heitur, H. (2014). Mikrovetika Chlorella vulgaris Beyerincki kasvatamine CO2 sidumise eesmärgil (Master's thesis).
https://hdl.handle.net/10492/1842 (2024 Feb. 05)
Eesti Maaülikool (Estonian University of Life Sciences), Estonia.
Growing yeast cultures (DBY12007) in the LAMBDA MINIFOR fermenter at steady state to study the aerobic glycolysis and energy flux
Slavov, N., Budnik, B. A., Schwab, D., Airoldi, E. M., & van Oudenaarden, A. (2014). Constant growth rate can be supported by decreasing energy flux and increasing aerobic glycolysis. Cell reports, 7(3), 705-714.
https://doi.org/10.1016/j.celrep.2014.03.057
Massachusetts Institute of Technology, USA; Harvard University, USA; Hubrecht Institute, Royal Netherlands Academy of Arts and Sciences and University Medical Center Utrecht, Netherlands and Princeton University, USA.
Selective and non-selective batch fermentation of date extract using Saccharomyces cerevisiae (commercial strain used in bakeries (wild strain), glucose selective strains ATCC 36858 and ATCC 36859) studied in LAMBDA MINIFOR fermentor
Putra, M. D., Abasaeed, A. E., Zeinelabdeen, M. A., Gaily, M. H., & Sulieman, A. K. (2014, April). Selective fermentation of pitted dates by S. cerevisiae for the production of concentrated fructose syrups and ethanol. In Journal of Physics: Conference Series (Vol. 495, No. 1, p. 012034). IOP Publishing.
https://doi.org/10.1088/1742-6596/495/1/012034
King Saud University, Chemical Engineering Department, Saudi Arabia
The metabolic stress response of tomato cell culture (Lycopersicum esculentum) to low oxygen studied using LAMBDA MINIFOR Bioreactor
Ampofo‐Asiama, J., Baiye, V. M. M., Hertog, M. L. A. T. M., Waelkens, E., Geeraerd, A. H., & Nicolai, B. M. (2014). The metabolic response of cultured tomato cells to low oxygen stress. Plant Biology, 16(3), 594-606.
https://doi.org/10.1111/plb.12094
KU Leuven, Belgium; Flanders Centre of Postharvest Technology (VCBT), Leuven, Belgium.
LAMBDA MINIFOR bioreactor to grow the oral bacteria (Streptococcus oralis, Actinomyces naeslundii, Veillonella parvula, Fusobacterium nucleatum, Aggregatibacter actinomycetemcomitans and Porphyromonas gingivalis) under planktonic conditions
Blanc, V., Isabal, S., Sanchez, M. C., Llama‐Palacios, A., Herrera, D., Sanz, M., & León, R. (2014). Characterization and application of a flow system for in vitro multispecies oral biofilm formation. Journal of Periodontal Research, 49(3), 323-332.
https://doi.org/10.1111/jre.12110
DENTAID S. L., Cerdanyola del Vallès, Spain; ETEP Research Group, University Complutense of Madrid, Spain.
LAMBDA MINIFOR Bioreactor used for recombinant protein (Chemokines) expression in E. coli
Kramp, B. (2014). Establishing the interaction between the CC chemokine ligand 5 and the receptors CCR1 and CCR (Doctoral dissertation, Aachen, Techn. Hochsch., Diss., 2013).
https://core.ac.uk/download/pdf/36589112.pdf (2024 Feb. 05)
RWTH Aachen, Germany.
Medium optimization and growth kinetics of S. marcescens were studied in a benchtop bioreactor LAMBDA MINIFOR 7L Advanced Kit: batch cultivations at 30 °C, 3 L/min aeration, 4 Hz stirring, pH 6, polypropylene glycol as antifoam.
Mohammed, S. J. (2014). Optimization Of medium Composition for increasing prodigiosin production by local isolate of Serratia marcescens. Doctoral thesis, Al-Khwarizmi College of engineering, Department of Biochemical engineering, University of Baghdad.
https://doi.org/10.13140/RG.2.2.18638.7968
2013:
Development of biofilm model (S. oralis, A. naeslundii, V. parvula, F. nucleatum, A. actinomycetemcomitans and P. gingivalis) in continuous flow in a LAMBDA MINIFOR 0.4L bioreactor.
Soto, I. S. (2013). Desarrollo del modelo de boca artificial en flujo continuo en el biorreactor Lambda Minifor. Universidad Complutense de Madrid Master en Ciencias Odontológicas.
https://docta.ucm.es/rest/api/core/bitstreams/39d8318b-a49b-4cb3-a164-e4faab18f52b/content (2024 Feb. 05)
Recombinant expression of the Met-CCL5, protease resistant CXCL12 (S4V) and F1-CX3CL1 in E. coli using LAMBDA MINIFOR fermenter/bioreactor to study their role in Cardiovascular disease (CVD)
Projahn, D. (2013). Generation, function and therapeutic application of chemotactic cytokines in cardiovascular diseases (Doctoral dissertation, Aachen, Techn. Hochsch., Diss., 2013).
https://publications.rwth-aachen.de/record/229207/files/4840.pdf (2024 Feb. 05)
RWTH Aachen, Germany.
Expression of Caf1 protein using Escherichia coli strain in LAMBDA MINIFOR fermentor to study mammalian cell adhesion, shape and number of focal adhesion
Machado Roque, A. I. (2013). Protein scaffolds for cell culture (Doctoral dissertation, Newcastle University).
URI: https://hdl.handle.net/10443/1843 (2024 Feb. 05)
Newcastle University, UK.
Controlled growth of Staphylococcus aureus under various concentrations of BAC (benzalkonium chloride) in LAMBDA MINIFOR fermentor
Cervinkova, D., Babak, V., Marosevic, D., Kubikova, I., & Jaglic, Z. (2013). The role of the qacA gene in mediating resistance to quaternary ammonium compounds. Microbial Drug Resistance, 19(3), 160-167.
https://doi.org/10.1089/mdr.2012.0154
Veterinary Research Institute, Brno, Czech Republic.
2012:
Effective production of Biobutanol from agricultural waste (giant hogweed, hay) using LAMBDA MINIFOR bench-top laboratory fermenter
Mezule, L., Tihomirova, K., Nescerecka, A., & Juhna, T. (2012). Biobutanol production from agricultural waste: A simple approach for pre-treatment and hydrolysis. Latvian Journal of Chemistry, 51(4), 407.
https://doi.org/10.2478/v10161-012-0028-5
2011:
Bioethanol production using Yeast (S. cerevisiae) in LAMBDA MINIFOR fermenter
Burešová, I., & Hřivna, L. (2011). Effect of wheat gluten proteins on bioethanol yield from grain. Applied Energy, 88(4), 1205-1210.
https://doi.org/10.1016/j.apenergy.2010.10.036
2010:
Anaerobic fermentation of the glucose component in dates extract by yeast Saccharomyces cerevisiae
Gaily, M. H., Elhassan, B. M., Abasaeed, A. E., & Al-Zahrani, S. M. (2010). A direct process for the production of high fructose syrups from dates extracts. International Journal of Food Engineering, 6(3).
https://doi.org/10.2202/1556-3758.1879
King Saud University, Saudi Arabia; University of Khartoum, Sudan
Study of the potential of tree tobacco stems (Nicotiana Glauca r. Grah.) as a bioethanol feedstock with the LAMBDA MINIFOR fermenter
Sánchez, F., Curt, M. D., Barreiro, M., Fernández, J., Agüera, J. M., Uceda, M., & Zaragoza, G. (2010). TREE TOBACCO (NICOTIANA GLAUCA R. GRAH.) STEMS AS A BIOETHANOL FEEDSTOCK. 18th European Biomass Conference and Exhibition, 3-7 May 2010, Lyon, France.
Do you sell/ship to the USA?
Yes, we do supply our instruments directly with door-to-door delivery option by the parcel services to the USA.
What is the availability of the product?
We have the instruments in stock. We would just have to configure the instruments according to your requirements and perform quality control before shipping.
Is there a warranty?
We offer a 2 year warranty for MINIFOR fermentor / bioreactor and 5 year warranty for the PRECIFLOW & MULTIFLOW peristaltic pumps.
Does this fermentor work on both mammalian cells and yeast cells?
Yes, MINIFOR fermentor and bioreactor can be used for mammalian and yeast cell cultures (More information at www.fermentor.net/applications).
Is there flexibility in the top plate to add or remove probes?
Yes, MINIFOR has free ports in the headspace for the additional probes (sensors). Multiple ports and other effective solutions in the fermentation glass vess make the MINIFOR configuration equivalent to 16 to 22 classical ports (it is possible to increase the number of ports – custom made solution)
Is the equipment suitable for use in pure / mixed culture?
Yes, MINIFOR is suitable for pure as well as mixed culture. The stirrer is strong and can easily be adapted according to the types of cultures and working volumes.
Why is MINIFOR perfectly suitable for parallel processes?
Each unit stays independent as it is equipped with a control panel and display and at a single glance shows the parameter values. All parameters are regulated locally inside each fermenter-bioreactor unit.
This allows fast and precise parameter regulation and never having to worry about leaving a vessel unattended. Further advantage is that in case there are problems with one unit, the other units will still keep running.
How important is the slowdown in parameter regulation while running 12 bioreactors in parallel?
An important aspect to consider – which, however, does not play a role in the LAMBDA MINIFOR parallel system because each MINIFOR fermenter comes with its proper regulation unit that measures and controls all parameters locally. As a consequence the quality of the measurement and regulation is not affected by long transmission times and dead times in regulation.
How much space is required for the MINIFOR unit?
Footprint: approximately a sheet of paper
Dimensions: 22 cm x 38 cm x 40 cm (W x H x D)
 Fermentacja ciągła (chemostat)
Zobacz więcej
Fermentacja ciągła (chemostat)
Zobacz więcej
 REDOX potential measurement [mV]
Zobacz więcej
REDOX potential measurement [mV]
Zobacz więcej
 MINI-4-GAS Automatic gas-mix
Zobacz więcej
MINI-4-GAS Automatic gas-mix
Zobacz więcej
 Automatic antifoam control
Zobacz więcej
Automatic antifoam control
Zobacz więcej
 Program PC - FNet
Zobacz więcej
Program PC - FNet
Zobacz więcej
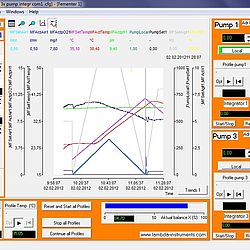 SIAM industrial fermentation software
Zobacz więcej
SIAM industrial fermentation software
Zobacz więcej
 MINI-4-GAS software module
Zobacz więcej
MINI-4-GAS software module
Zobacz więcej
 OXYMETER
O2 concentration measurement (0-25%)
Zobacz więcej
OXYMETER
O2 concentration measurement (0-25%)
Zobacz więcej
 CARBOMETER
CO2 concentration measurement (0-100%)
Zobacz więcej
CARBOMETER
CO2 concentration measurement (0-100%)
Zobacz więcej
 METHAMETER
CH4 concentration measurement (0-100%)
Zobacz więcej
METHAMETER
CH4 concentration measurement (0-100%)
Zobacz więcej
 Additional PRECIFLOW pump line
PRECIFLOW pump 0-600 ml/h, reagent bottle with pipes, fittings, filter, tubing
Zobacz więcej
Additional PRECIFLOW pump line
PRECIFLOW pump 0-600 ml/h, reagent bottle with pipes, fittings, filter, tubing
Zobacz więcej
 Additional MULTIFLOW pump line
MULTIFLOW pump, reagent bottle with pipes, fittings, filter and tubing
Zobacz więcej
Additional MULTIFLOW pump line
MULTIFLOW pump, reagent bottle with pipes, fittings, filter and tubing
Zobacz więcej
