Laboratorní fermentor-bioreaktor
Laboratorní fermentor-bioreaktor
Stolní laboratorní fermentor MINIFOR LAMBDA byl vyvinut na základě dlouhé osobní praktické zkušenosti s fermentacemi.
LAMBDA MINIFOR laboratorní fermentor-bioreaktor
Cílem bylo navrhnout spolehlivý kompaktní praktický fermentor, který byl snadno ovladatelný a schopný měřit a kontrolovat všechny důležité parametry biologické kultury v kvalitě dostupné jen u mnohem dražších přístrojů
Fermentor potřebuje minimální plochu na laboratorním stole a je koncipován pro fermentace v objemech od 35 ml až do 6 l. Několik fermentorů může být přisunuto k sobě, přičemž vznikne souprava umožňující provádět několik fermentací zároveň. Toto uspořádání je vhodné při optimalizaci růstových parametrů kultur, biotransformací, hledání různých enzymových aktivit apod. Každý fermentor má svou vlastní elektroniku, displej, ovládání a může být individuálně programován. Fermentor nebo celá řada fermentorů může být řízena programem FNet nebo SIAM, které umožňují řízení, zapisování a zpracování dat podle požadované potřeby
K podstatnému snížení ceny fermentoru došlo díky zavedení inovací založených na zkušenostech dlouhodobé praxe v oboru:
- Nádoba fermentoru je vybavena hrdly se závity Pyrex se silikonovým těsněním, což zaručuje sterilitu a snadnou obsluhu. Odpadají drahé nerezové příruby a přechod k nádobě jiného objemu je podstatně levnější.
- Místo klasických vrtulkových či slabých magnetických míchaček je použit nový magnetický mixér, který netvoří vír a produkuje méně pěny. Vratný pohyb vede k intensivnímu míchání média a k dobrému přenosu kyslíku při maximální šetrnosti k buňkám. Membrána umístěná ve víku tančíku ho hermeticky uzavírá a plně nahrazuje drahou magnetickou spojku.
- Velkou novinkou je zavedení nového pružného míchacího disku FISH TAIL, který je šetrný pro buněčné kultury. Odstraňuje hrany a víry u klasických míchaček.
- Zcela nové je ohřívání kultury pomocí tepelného zářiče umístěného pod nádobou. Tepelné záření je médiem rovnoměrně absorbováno a nikde nedochází k přehřátí. Tento nový způsob ohřívání zabrání připálení kultury na povrchu topných těles umístěných uvnitř média či ušetří náklady na nádobu s dvojitým pláštěm a ohřevného vodního okruhu s termostatem. Z okolí tančíku takto také zmizí přívodní hadice, šňůry. Navíc umožňuje přirozené chlazení reaktoru, což přispívá k přesné a snadné regulaci teploty media.
- Fermentor LAMBDA MINIFOR používá novou umělou hmotu, (která není přímo v kontaktu s kulturou) namísto běžného a nákladného víka z nerezu, který uzavírá fermentory.
- Průtok vzduchu je měřen hmotovým průtokoměrem, který ve srovnání s trubičkovým průtokoměrem dává spolehlivé průtokové údaje i při měnícím se tlaku a tímto umožňuje přesné měření a regulaci rozpuštěného kyslíku změnou průtoku vzduchu.
- Použití moderních mikroprocesorů umožnilo vyrobit fermentor neuvěřitelně malých rozměrů i přesto, že v základní verzi je regulováno a měřeno až šest různých parametrů
Základní jednotka
V základní jednotce je uloženo napájení, IR zářič, průtokoměr, elektronika, kabelová spojení a mechanická výztuha. Přístroj je kvůli přehlednosti konstruován stupňovitě. V přední části základní jednotky je umístěn ovládací panel s displejem, mikroprocesor a elektronika. Kovový kryt základní jednotky slouží jako plocha pro umístění nádoby fermentoru, pump a lahví s různými roztoky. Kvůli snadnému přístupu jsou pumpy postaveny na nerezových poličkách, které jsou libovolně nastavitelné na dvou zadních tyčích. Na zadní straně základní jednotky jsou konektory k připojení pump a síťový kabel. Lahve s médiem a korekčními roztoky jsou umístěny v praktických držácích s magnetem, který umožňuje bezpečné umístění na libovolném místě vyhrazené plochy. Najde zde místo až sedm lahví.
Ovládání
Ovládací panel se skládá ze čtyřřádkového, podsvíceného displeje a tlačítkového ovladače. Všechny veličiny (teplota, pH, pO2, průtok vzduchu, míchání a volitelný parametr) jsou přehledné na první pohled. Ovládání je jednoduché a logické. Při překročení nastavených minimálních nebo maximálních hodnot parametrů zazní alarm, zmíněná hodnota na displeji je označena hvězdičkou a na společném výstupu alarmů se objeví signál sloužící k ovládání dalších zařízení (např. sběrače frakcí apod.).
Každý fermentor může být připojen na PC přes rozhraní RS 485 nebo RS 232. PC používá k regulaci fermentační program FNet nebo SIAM, díky tomuto program jsou možnosti zadání a zpracování dat prakticky neomezené. Počet ovládaných fermentorů též není prakticky omezen (FNet je pro 6 fermentorů a SIAM i pro 99 zařízení).
Nádoba fermentoru
Obvykle dodávaná fermentační nádoba má pracovní objem až 1,7 l (další velikosti nádob s pracovními objemy od 35 ml až do 6 l jsou také k dispozici a dodávány na vyžádání). Nádoby jsou zhotoveny ze skla laboratorní kvality Pyrex a vybaveny hrdly se šroubovými uzávěry běžně používanými u buněčných kultur. Na centrálním hrdle je našroubován vertikální mixér. Boční závitová hrdla jsou určena pro odvod vzduchu, pH elektrodu s termočidlem, kyslíkovou elektrodu, dávkování korekčních roztoků (H+, OH-, živiny, odpěňovač), očkování a odběr vzorků (ekvivalent 16ti portů). Fermentační nádoby se sterilizují v autoklávu.
|
Typ nádoby: |
0,3 |
0,4 |
1 |
3 |
7 |
|
Objem [L]: *) |
0.035–0.4 |
0.15–0.45 |
0.3–1.7 |
0.5–3 |
1–6 |
|
Výška [cm]: **) |
34 |
22 |
34 |
37 |
50 |
|
Max. průměr [cm]: **) |
22 |
23 |
25 |
34 |
30 |
*) Objem: přibližné minimální a maximální pracovní objemy. Pracovní objemy se mohou lišit s ohledem na podmínky každého použití.
**) Výška a max. průměr: přibližné dimenze nádoby s typickými příslušenstvími pro autoklávy. Může se lišit podle konfigurace fermentoru / bioreaktoru a použitého příslušenství.
Pojistný přetlakový ventil
Sklo je optimální materiál pro laboratorní fermentory. Sklo je inertní a neuvolňuje nežádoucí látky do média. Bohužel, sklo je křehké a není odolné vůči vysokému tlaku. Za běžných podmínek to není problém, protože tlak ve fermentační nádobě je nízký i při použití mikrofiltru pro odchozí vzduch.
Avšak pokud je výstupní mikrofiltr zablokován (například díky dlouhodobému opakovanému požívání či díky protržení) potom tlak v nádobě může být stejný jako vstupní tlak plynu (doporučený tlak 0,1 MPa). To může být nebezpečné pro skleněnou nádobu, neboť sklo je časem opotřebováváno procesem sterilizace nebo jeho povrch může být nedopatřením poškrábán apod. Všechny tyto vlivy mohou snížit odolnost fermentační skleněné nádoby proti tlaku.
Pokud se tlak uvnitř nádoby blíží 0,1 MPa, přetlakový ventil se otevře. S rostoucím tlakem se únik plynu zvyšuje, dokud není dosažena bezpečná hodnota (unikající hvízdající vzduch lze slyšet, což by mělo upozornit uživatele). V tomto momentu by měl být snížen vstupní tlak vzduchu a výstupní mikrofiltr vyměněn za nový.
Míchání
Klasické vrtulové míchačky byly nahrazeny vertikálním excentrickým mixérem, který pro míchání v laboratorních objemech přináší nesporné výhody. Intenzita míchání je řízena frekvencí (0.1– 20.0 Hz) a amplitudou zdvihu (12 mm). Frekvence míchání je kontrolovaná mikroprocesorem. Mixér je poháněn bezkolektorovým motorem (50W) umístěným vertikálně nad nádobou fermentoru pomocí magnetické spojky. Je spojen dutou osou s jedním, nebo několika míchacími disky. Vzduch je zaváděn pod spodní disk, což zaručuje optimální převod kyslíku do média. Nevzniká žádný vír, jako je tomu u vrtulkových míchaček. Tento způsob míchání je ke kultuře šetrnější, neboť se nevytvářejí přetlaky vznikající na hraně rychle se točící vrtulky. Přepážky (baffles) odpadají. Ještě mnohem šetrnější je nový biomimetický pružný míchací disk FISH TAIL.
Regulace teploty
Nový infračervený zářič umístěný pod nádobou fermentoru se zlatým parabolickým reflektorem se používá k ohřívání média. Tepelné záření (150 W) je soustředěno v dolní části nádrže a je absorbováno médiem podobným způsobem jako, voda absorbuje sluneční tepelné záření (vzniká přirozená konvekce). Záření je rovnoměrně rozptýleno v médiu a nedochází k nebezpečnému přehřátí a denaturaci kultury i při velmi malých objemech kultury. Vzhledem k rychlému působení a nízké teplotní kapacitě spirály zářiče je regulace teploty podstatně přesnější. Teplotní čidlo je umístěno v baničce skleněné pH elektrody a proto reaguje velmi rychle a složí zároveň k automatické teplotní kompenzaci pH a pO2.
Měření a stabilizace pH
Hodnota pH je měřena kombinovanou sterilizovanou pH elektrodou s vestavěným teplotním čidlem(Mettler). Přídavky kyseliny nebo báze jsou kontrolovány mikroprocesorem. Rychlost přídavku je vypočítána tak, aby nedošlo k přesažení nastavené hodnoty. Nastavování konstant jako je tomu u PID regulátoru úplně odpadá. Korekční roztoky jsou pumpovány pumpami PRECIFLOW, MULTIFLOW, Hi-FLOW či MAXIFLOW. Rychlost pumpy je regulována s využitím celého rychlostního rozsahu pumpy 0– 100 %. Tento způsob regulace je jemnější a přesnější než obvyklé zapínání pumpy s pevně nastavitelnou rychlostí. Pumpy nejsou pevně zabudovány a lze je použít i jinde nezávisle na fermentoru. Je možné zpracování dat činnosti pumpy Integrátorem, neboť údaj spotřeby korekčních roztoků v čase pomocí integrátoru umožňuje kvantitativní vyjádření aktivity kultury a jejího růstu. Nákladné a rozporuplné měření optické denzity (hustoty) media odpadá.
Měření a regulace rozpuštěného kyslíku
Koncentrace kyslíku v médiu je měřena sterilizovanou Clarkovou kyslíkovou elektrodou s automatickou teplotní kompenzací. Použitím velké katody je dosaženo rychlé odpovědi elektrody i při použití zpevněné membrány(Mettler) a zároveň je zkrácena doba polarizace. Hlavní část membrány je chráněna proti mechanickému poškození tenkou stěnou z PEEK. Mikroprocesor provádí poloautomatickou dvoubodovou kalibraci s automatickou kompenzací teploty. K regulaci koncentrace kyslíku mediu dochází změnou průtoku vzduchu.
Přívod a odvod vzduchu
Průtok lze nastavit od 0 do 5 l/min po 0,01 l/min krocích při použití hmotového průtokoměru s automatizovaným jehlovým ventilem. Toto měření je nezávislé na tlaku a na teplotě okolního vzduchu.
Vzduch je přiváděn přes sterilní filtr. Spotřebovaný vzduch je odváděn ven z reaktoru přes podobný sterilní filtr. Je také možnost dodat chladič s elektronickým chladícím elementem Peltier (přívod chladící vody není zapotřebí). Chladič zabraňuje ztrátě vody z fermentoru odpařením. Do media vzduch vstupuje přes elastický, samočistící mikrosparger na dolním konci osy míchačky a je dobře rozptýlen v mediu.
Očkování, přídavky a odebírání vzorků
Očkování, přídavky kyseliny, báze, prostředku proti pěnění a odebírání vzorků jsou prováděny přes čtyři nerezové kapiláry, které jsou opatřeny na horním konci PEEK spojkami či uzávěry s dvojitým těsněním LAMBDA SEAL.
Sterilizace
Po oddělení kabelů a uzavření konektorů čepičkami lze celý laboratorní fermentor sterilizovat v autoklávu (např. 120 °C, 25 min.). Díky jednostěnným nádobám je přestup tepla vynikající.
Rozměry
Malý půdorys fermentoru (22 × 40 cm) uspoří kromě nákladů na suroviny i pracovní plochu v laboratoři. Je také zachován dobrý přístup ke všem částem fermentoru.
Kvalitní peristaltické pumpy
Na zadních konzolách je místo až pro čtyři pumpy (LAMBDA PRECIFLOW, MULTIFLOW, HIFLOW, MAXIFLOW). Jejich připojení je řešeno jediným kabelem pro napájení a všechny signály. Pumpy jsou připojeny do odpovídajících zásuvek na zadní straně fermentoru. Tyto pumpy jsou kompaktní, velice kvalitní a úsporné v provozu, neboť používají levné hadičky a přesto je průtok konstantní a životnost dlouhá. Jsou speciálně vhodné pro dlouhé a kontinuální procesy.
Vzhledem k tomu, že čerpadla nejsou integrovaná do fermentoru, mohou být použita i pro jiné účely jinde v laboratoři (např. pro chromatografii atd.), což představuje značné úspory pro uživatele.
Měření a regulace průtoku plynů
LAMBDA MASSFLOW je nový regulátor průtoku plynu speciálně určený pro společné použití s laboratorními fermentory LAMBDA. Umožňuje řízení pH buněčné kultury přidáváním oxidu uhličitého eventuálně dusíku bez použití dalších regulačních stanic. Regulátor je možné použít i samostatně nezávisle na fermentoru, protože všechny funkce jsou přístupné z předního panelu.
Průtok plynu je měřen kvalitním hmotnostním průtokoměrem, přičemž hodnota průtoku je zobrazena na digitálním displeji. Linearita měření je ±3 % a opakovatelnost měření ± 0,5 %. Průtok plynu je regulován speciálně vyvinutým proporcionálním jehlovým ventilem kontrolovaným mikroprocesorem. Průtok plynu lze naprogramovat až v 50 krocích. Objemové signály umožňují stanovit objem protékajícího plynu. Velkou výhodou je také možnost poznamenání prošlých objemů v závislosti na čase.
Několik regulátorů lze kombinovat podle potřeby uživatele a ve spojení s odpovídajícím přídavkem k ovládacímu programu SIAM je vytvořena plynová stanice GAS STATION až pro 4 různé plyny. Tato stanice je unikátní v kvalitě, konceptu i ceně.
LAMBDA CARBOMETER
- umožňuje měřit koncentraci CO2 v odchozím plynu (0-100 %)
Technické parametry:
• Přesnost měření CO2: ±3 %
• Napájení: 12V/6W
• Rozměry: 105 × 80 × 170 mm (W × H × D)
• Váha: 800 g
• Záruka: 2 roky
LAMBDA OXYMETER
- umožňuje měřit koncentraci O2 v odchozím plynu (0-100 %)
• Přesnost měření: ±2 %
• Napájení: 12V/6W
• Rozměry: 105 x 80 x 170 mm (W × H × D)
• Váha: 600 g
• Záruka: 2 roky
Ovládání, program FNet a SIAM
Pro monitorování a řízení fermentačních procesů a buněčných kultur v LAMBDA fermentoru byl speciálně vyvinut program FNet. Nabízí jednoduchou a logickou obsluhu a optimální využití fermentoru. Počítačem lze přímo ovládat až 6 fermentorů, 12 integrátorů a 6 pump. Pro mimořádně náročná měření je k dispozici fermentační program SIAM, který uspokojí téměř každý požadavek. Počet ovládaných fermentorů též není prakticky omezen (až 99 ovládaných zařízení). Software běží pod Windows NT, 2000, XP, Vista and Windows 7 a 8.
Rozměry: 22 x 40 x 38 cm (W x D x H)
Displej: LCD 4 x 40 digits with backlight illumination
Fermentační nádoba: Pyrex glass with 6 to 8 side necks; 0.3, 0.4, 1, 3, 7 liter vessels
Tepelný zdroj: High efficiency 150 W infrared (IR) radiation heat source with gilded parabolic reflector
Rozsah regulace teploty: from 5°C over RT to 70°C
Měření teploty: from 0 to 99.9°C in 0.1°C steps
Přesnost teploty: +/- 0.2°C (0 to 60°C)
Teplotní čidlo: Pt 100 incorporated in the glass electrode of the pH probe
Měření a regulace pH: sterilisable pH electrode pH 0-14 with automatic temperature correction, two-point semiautomatic calibration and Variopin connector
Rozlišení: 0.01 pH unit
Přesnost: +/- 0.02 pH unit
Měření a regulace kyslíku: sterilisable Clark type oxygen sensor with fast response, automatic temperature correction, two-point semiautomatic calibration, dissolved oxygen (DO) control through regulation of the airflow rate
Rozsah měření: 0 to 25 mg oxygen/ l, in 0.1 mg/l steps
Měření průtoku vzduchu: 0 to 5 l/min in 0.01 l/min steps, measured by precise mass flow meter, linearity +/- 3%, reproducibility +/- 0.5%
Regulace vzduchu: proportional valve controlled by microprocessor
Tlak vzduchu: 0.05 – 0.2 MPa (0.5 - 2 atm)
Míchání: 50 W Vibromixer 0 to 20 Hz (0 to 1200 rpm) in 0.1 Hz steps (6 rpm) with 1 or more stirring discs; Sterility similar to magnetic coupling
Volitelná regulace: an additional parameter can be controlled by the instrument (foaming control, weight (for continuous cultures), pCO2, redox potential, conductivity, optical density, etc.); with standard 0-10V or 0-20mA output
Odběr vzorků: One large quadruple sampling or additions port with four needles with LAMBDA PEEK double-seal connections, used for sampling, inoculation, antifoam, feeds, harvest, addition of correction solutions etc., additional double ports are available.
Pumpy: up to 4 independent pumps (PRECIFLOW, MULTIFLOW, HIFLOW or MAXIFLOW) with speed variation from 0 to 100 % can be used with MINIFOR lab fermenter-bioreactor
Gas flow control: In addition to pumps, several electronic flow controllers with flow rate ranges of 0-5 l/min (MASSFLOW 5000) or 0-500 ml/min (MASSFLOW 500) can be used for the controlled addition of gases (e.g. N2, O2, air, CO2) in cell cultures; freely configurable gas station module
Pracovní teplota: 0 – 40 °C
Pracovní vlhkost: 0 - 90 % RH, not condensing
Váha: 7.5 kg
PC ovládání: complete PC control and data processing using the fermentation software FNet (for up to 6 MINIFOR fermenters) or SIAM (for an even higher number of instruments)
- EN - LAMBDA MINIFOR Laboratory Fermenter-Bioreactor LEAFLET (pdf)
- EN - 20 innovations of LAMBDA MINIFOR laboratory-scale bioreactors — Overview and Benefits (pdf)
- EN - LAMBDA MINIFOR laboratory fermenter and bench-top bioreactor at universities and highschools (pdf)
- EN - Operation manual: MINIFOR lab fermentor-bioreactor (pdf)
- EN - Infographics: Overview of innovations in MINIFOR lab fermenter and bioreactor (pdf)
- EN - Quick overview of MINIFOR bioreactor vessels with connections, probes & tubing lines (pdf)
- EN - Peltier electronic cooling loop for Minifor fermentor (pdf)
- EN - PUMP-FLOW INTEGRATOR replaces the need for optical density measurements in fermenters and bioreactors (pdf)
- EN - REDOX potential measurement for MINIFOR laboratory fermentor (pdf)
- EN - MINI-4-GAS, the automatic gas mixing module (pdf)
- EN - How to compare the cost and real value of a laboratory fermentor? (pdf)
- EN - Solitary teamplayer in parallel processes - LAMBDA MINIFOR laboratory fermenter and bioreactor (pdf)
- DE - UNI _ LAMBDA MINIFOR Laborfermenter und Tischbioreaktor an Hochschulen (pdf)
- DE - Montageanleitung _ Kurzübersicht der Bioreaktorgefässe LAMBDA MINIFOR mit Anschlüssen, Sonden und Schlauchlinien (pdf)
- DE - Broschüre _ MINIFOR Laborfermenter Bioreaktor (pdf)
- DE - Parallelreaktor _ LAMBDA MINIFOR Laborfermenter Bioreaktor der Einzelgänger im Parallelsystem (pdf)
- DE - Bedienungsanleitung _ LAMBDA MINIFOR Labor-Tischfermenter und Bioreaktor (pdf)
- DE - LAMBDA MINIFOR Laborfermenter und Bioreaktor - Innovationsuebersicht und Vorteile (pdf)
- FR - MINIFOR - fermenteur de laboratoire (pdf)
- FR - Installation de cuve LAMBDA MINIFOR (pdf)
- FR - LAMBDA MINIFOR Start-Up Kit - mode d'emploie (pdf)
- FR - LAMBDA MINIFOR fermenteur / bioreacteur - Resume des innovations et avantages (pdf)
- FR - LAMBDA MINIFOR fermenteur de laboratoire-bioréacteur de paillasse et son utilisation dans les écoles et universités (pdf)
- FR - Le fermenteur et bioréacteur de laboratoire MINIFOR: Le joueur solitaire dans l’équipe des procédés en parallèle (pdf)
- FR - Comment comparer le coût d’un fermenteur ou bioréacteur avec sa valeur réelle ? (pdf)
- RU - Лабораторный ферменторбиореактор ЛАМБДА МИНИФОР (pdf)
- CZ - MINIFOR - laboratorní fermentor (pdf)
- ES - Manual de operaciones - LAMBDA MINIFOR Fermentador-Biorreactor de Laboratorio (pdf)
- ES - LAMBDA MINIFOR Biorreactor-fermentador de laboratorio - resumen de innovaciones y ventajas (pdf)
- ES - Fermentador-biorreactor de laboratorio LAMBDA MINIFOR para las escuelas y universidades (pdf)
- ES - MINIFOR - fermentador de laboratorio (pdf)
- ES - Fermentador y biorreactor LAMBDA MINIFOR: El solitario en procesos paralelos (pdf)
- ES - ¿Cómo comparar el coste y el valor real de un fermentador y biorreactor de laboratorio? (pdf)
2024
Simultánní sacharifikace a fermentace (SSF): Bioreaktor LAMBDA MINIFOR byl použit jak pro fermentaci předupravené pevné biomasy (10 %) za přítomnosti celulázy, β-glukosidázy a inokulace Lactobacillus rhamnosus (1.7 L, 37 °C, pH=5.5, 72 h), tak pro následnou fermentaci hydrolyzátů s Bacillus megaterium (1.7 L, 35 °C, 48 h).
Senila, L., Kovacs, E., Resz, M. A., Senila, M., Becze, A., & Roman, C. (2024). Life Cycle Assessment (LCA) of Bioplastics Production from Lignocellulosic Waste (Study Case: PLA and PHB). Polymers 2024, 16, 3330.
https://doi.org/10.3390/polym16233330
Smíšené inokulum bylo naočkováno do reakční komory bioreaktoru LAMBDA MINIFOR, který byl udržován při teplotě 37 °C za anaerobních podmínek.
Khan, S. N., Ribeiro‐Vidal, H., Virto, L., Bravo, E., Nuevo, P., Koldsland, O. C., Hjortsjö, C. & Sanz, M. (2024). The Decontamination Effect of an Oscillating Chitosan Brush Compared With an Ultrasonic PEEK‐Tip: An In Vitro Study Using a Dynamic Biofilm Model. Clinical Oral Implants Research.
https://doi.org/10.1111/clr.14360
Várková ko-kultivační fermentace datlového sirupu se S. cerevisiae a P. stipitis ATCC 58785 byla provedena v míchaném tankovém fermentoru LAMBDA MINIFOR 1L Advanced Kit.
Shalsh, F. J., Gatte, E. H., Alsultan, I. I., Tariq, F. Z., Jassim, S. M., Saleh, M. T., & Alrazzaq, N. A. (2024). Bioplastic Compounds of Succinic Acid from Agriculture Waste; Date Palm Syrup And Date Palm Fronds. Nepal Journal of Biotechnology, 12(1), 32-39.
https://doi.org/10.54796/njb.v12i1.310
In vitro vývoj dynamického modelu vícedruhového biofilmu na povrchu implantátů: Planktonický růst směsi šesti různých bakteriálních kmenů v bioreaktoru LAMBDA MINIFOR (12 h), následovaný kontinuální kultivací (průtok 30 ml/h) přes 2 Robbinsova zařízení obsahující sterilní implantáty (37 °C, anaerobní prostředí, 72 h).
Khan, S. (2024). Efficacy of Mechanical Decontamination Strategies in the Treatment of Peri-implantitis. Doctoral thesis, University of Oslo.
URI: https://hdl.handle.net/10852/111365 (2024 August 07)
Dynamický model vícedruhového biofilmu in vitro: V bioreaktoru LAMBDA MINIFOR je po celou dobu inkubace (růst biofilmu na povrchu implantátu) udržována teplota kultivačního média 37 °C, pH 7.2 a anaerobní atmosféra (rovnováha 10 % H2, 10 % CO2 a N2).
Bravo, E., Arce, M., Ribeiro-Vidal, H., Herrera, D., & Sanz, M. (2024). The Impact of Candida albicans in the Development, Kinetics, Structure, and Cell Viability of Biofilms on Implant Surfaces—An In Vitro Study with a Validated Multispecies Biofilm Model. International Journal of Molecular Sciences, 25(6), 3277.
https://doi.org/10.3390/ijms25063277
Submerged batch (konsorcia) a Fed-batch (L. coryniformis) fermentace v bioreaktoru s míchanou nádobou LAMBDA MINIFOR a softwarem SIAM: 72 h, konečné pracovní objemy = 200 ml, T = 37 ± 0.5 °C, míchání 0.5 Hz, šetřící CO2 při 0.04 l/min, pH 6.5 ± 0.5 s použitím 1 M NaOH a 1 M H2SO4 pro automatickou úpravu pH; vzorky byly odebírány v pravidelných intervalech.
Buljubašić, E., Bambace, M. F., Christensen, M. H. L., Ng, K. S., Huertas‐Díaz, L., Sundekilde, U., Marietou, A. & Schwab, C. (2024). Novel Lactobacillaceae strains and consortia to produce propionate‐containing fermentates as biopreservatives. Microbial Biotechnology, 17(2), e14392.
https://doi.org/10.1111/1751-7915.14392
Byl použit in vitro model vícedruhového dynamického biofilmu, který byl ověřen na biofilmech rostoucích na povrchu implantátů: Bioreaktor LAMBDA MINIFOR udržuje médium BHI obohacené o proteiny za stabilních podmínek: 37 °C, pH 7.2 a anaerobní atmosféru přímým čerpáním anaerobní směsi plynů (10 % H2, 10 % CO2 a rovnovážný N2), přičemž tlak je po celou dobu inkubace konstantní.
Bravo, E., Arce, M., Ribeiro-Vidal, H., Herrera, D., & Sanz, M. (2024). The Impact of Candida albicans in the Development, Kinetics, Structure, and Cell Viability of Biofilms on Implant Surfaces. An In Vitro Study with a Validated Multispecies Biofilm Model.
https://doi.org/10.20944/preprints202402.1137.v1
Simulovaný model lidského tlustého střeva s využitím LAMBDA MINIFOR bioreaktoru se základním živným médiem (37 °C, pH 6.8) a fekálními kaly
Pusuntisumpun, N., Tunsagool, P., Nitisinprasert, S., & Nakphaichit, M. (2024). Impacts of combining Limosilactobacillus reuteri KUB‐AC5 and Limosilactobacillus fermentum KUB‐D18 on overweight gut microbiota using a simulated human colon model. International Journal of Food Science & Technology.
https://doi.org/10.1111/ijfs.16941
400 ml izolovaných buněk rajčat v bioreaktoru LAMBDA MINIFOR (20 °C, pH 5.8) bylo proplachováno (10 l/h) za účelem dosažení různých koncentrací O2 (21 kPa, 5 kPa a 0 kPa) pro studium posklizňových ztrát ovoce a zeleniny během skladování v řízené atmosféře v důsledku nízkého tlaku O2.
Mahomud, M. S., Islam, M., & Roy, J. (2024). Effect of low oxygen stress on the metabolic responses of tomato fruit cells. Heliyon, e24566.
https://doi.org/10.1016/j.heliyon.2024.e24566
2023
Hülber-Beyer, É. A., Nemestóthy, N., & Bélafi-Bakó, K. (2023). Case Study of Continuous Itaconic Acid Fermentation by Aspergillus Terreus in a Bench-Scale Bioreactor. Hungarian Journal of Industry and Chemistry, 51(2), 57-63.
https://doi.org/10.33927/hjic-2023-19
Obrázky morfologie během fermentace: Obr. 1 na https://hjic.mk.uni-pannon.hu/index.php/hjic/article/view/1214/1092 (2024 Feb. 08)
Senila, L., Cadar, O., Kovacs, E., Gal, E., Dan, M., Stupar, Z., Simedru, D., Senila, M. & Roman, C. (2023). L-Poly(lactic acid) Production by Microwave Irradiation of Lactic Acid Obtained from Lignocellulosic Wastes. Int. J. Mol. Sci. 2023, 24, 9817.
Senila, L., Gál, E., Kovacs, E., Cadar, O., Dan, M., Senila, M. & Roman, C. (2023). Poly(3-hydroxybutyrate) Production from Lignocellulosic Wastes Using Bacillus megaterium ATCC 14581. Polymers. 2023, 15, 4488.
Bravo, E., Serrano, B., Ribeiro-Vidal, H., Virto, L., Sánchez, I.S., Herrera, D. & Sanz, M. (2023). Biofilm formation on dental implants with a hybrid surface microtopography: An in vitro study in a validated multispecies dynamic biofilm model. John Wiley & Sons, Ltd., 0905-7161. Clinical Oral Implants Research, Volume 34, Issue 5, May 2023 Pages i-iii, 405-541.
Simulace modelu střeva in-vitro pomocí LAMBDA MINIFOR 0.3L: Vsádková fermentace za anaerobních podmínek (37 °C, pH 6.8 - 6.9, 24 h) lidské fekální kaše (1 % (v/v)) za účelem vyhodnocení vlivu kofermentace extraktů Triphala (1 mg/ml) na mikrobiotu a metabolické změny.
Kwandee, P., Somnuk, S., Wanikorn, B., Nakphaichit, M. & Tunsagool, P. (2023). Efficacy of Triphala extracts on the changes of obese fecal microbiome and metabolome in the human gut model. Journal of Traditional and Complementary Medicine, Volume 13, Issue 2, 2023, Pages 207-217, ISSN 2225-4110.
Simulační model trávícího traktu (SHIME) s fermentory LAMBDA MINIFOR 0.3L. Každý simulátor lidského střevního mikrobiálního ekosystému se skládá z pěti fermentorů, z nichž každý imituje jiný segment lidského gastrointestinálního traktu.
Video https://www.youtube.com/watch?v=hXcpa0bXu6Q prezentuje Assoc. Prof. Massalin Nakphaichit před fermentory LAMBDA MINIFOR použité v modelu SHIME. Katedra biotechnologie, Fakulta agroprůmyslu, Kasetsart University.
Ve stolním bioreaktoru LAMBDA MINIFOR 7L s programovatelnými sondami byly vyvinuty RODM (soubor organismů s novým metabolismem, které účinně rozkládají vysoce koncentrované aromatické látky) pro mikrobiální ekosystém s vysokou hustotou.
Ahmad, M., Yousaf, M., Han, J.-C., Huang, Y., Zhou, Y. & Tang, Z. (2023). Development of Biocatalytic Microbial Ecosystem (FPUS@RODMs@In-PAOREs) for Rapid and Sustainable Degradation of Various Refractory Organics. Journal of Hazardous Materials, 2023, 131514, ISSN 0304-3894,
https://doi.org/10.1016/j.jhazmat.2023.131514
Hybridomové buňky (inokulace 4.0 × 10E5 buněk/ml (90 % životaschopnost)): V bioreaktoru s míchanou nádobou LAMBDA MINIFOR.
Llamo, A., Hernández, D., García, C., González, M., Ferro, W., Garay, H., Diago, D., Fajardo, A., Espinosa, L., Padilla, S., Gómez, L., Chinea, G. & and Valdés, R. (2023). Gamma-Immunoglobulin Response Characterization, in COVID-19 Convalescent Patients, Against the Spike Protein S2 Subunit with Eight Linear Peptides for Monoclonal Antibody Generation. BioProcess J, 2023; 22.
https://doi.org/10.12665/J22OA.Llamo
Optimalizace hydrolýzy rostlinných olejů katalizované lypázou: Řízená a monitorovná biorektorem LAMBDA MINIFOREM (pH, teplota, reakční doba, enzymová nálož a poměr olej/voda reakční směsi).Faillace, E., Brunini-Bronzini de Caraffa, V., Mariani, M., Berti, L., Maury, J. & Vincenti, S. (2023). Optimizing the First Step of the Biocatalytic Process for Green Leaf Volatiles Production: Lipase-Catalyzed Hydrolysis of Three Vegetable Oils. International Journal of Molecular Sciences. 2023; 24(15):12274.
Dumitru, M. & Ciurescu, G. (2023). Optimization of the fermentation conditions and survival of Bacillus licheniformis as freeze-dried powder for animal probiotic applications. Scientific Papers. Series D. Animal Science. Vol. LXVI, No. 2, 2023; ISSN 2285-5750; ISSN CD-ROM 2285-5769; ISSN Online 2393-2260; ISSN-L 2285-5750. https://www.animalsciencejournal.usamv.ro/pdf/2023/issue_2/Art10.pdf (2024 Jan. 02)
Alonso-Español, A., Bravo, E., Ribeiro-Vidal, H., Virto, L., Herrera, D., Alonso, B. & Sanz, M. (2023). The Antimicrobial Activity of Curcumin and Xanthohumol on Bacterial Biofilms Developed over Dental Implant Surfaces. Int. J. Mol. Sci. 2023, 24, 2335.
Mléko bylo pasterováno při 70 °C po dobu 30 minut ve fermentorech LAMBDA MINIFOR.
/
LAMBDA MINIFOR fermentory: Testy vlivu teploty na růst kvasinek Kazachstania unispora (inital ~10e6 CFU/ml) v mléce (800 ml, ~6 % laktózy): od 5 °C do 40 °C (5, 10, 15, 20, 25, 27, 30, 32, 35, 37 a 40 °C) při pH 5,6 (automatická úprava pomocí 2 M NaOH) a 240 otáčkách za minutu, až do dosažení stacionární fáze (inline senzor zákalu v blízkém infračerveném spektru Optek FC20- ASD10-N).
/
Fermentory LAMBDA MINIFOR pro kokultivační pokusy s Lacticaseibacillus casei a Kazachstania unispora při 25 °C v modifikovaném médiu MRS a v kobylím mléce (inital: ~10e6 CFU/ml, pH = 6.8).
/
Fermentory LAMBDA MINIFOR pro kokultivační pokusy při 30 °C Lactobacillus kefiri a Kazachstania unispora v modifikovaných médiích MRS i v kobylím mléce (inital: ~10e6 CFU/ml, pH = 6.8).
Kondybayev, A., Achir, N., Mestres, C., Collombel, I., Strub, C., Grabulos, J., Akhmetsadykov, N., Aubakirova, A., Kamidinkyzy, U., Ghanmi, W. & Konuspayeva, G. (2023). Growth Kinetics of Kazachstania unispora and Its Interaction with Lactic Acid Bacteria during Qymyz Production. Fermentation 2023, 9, 101.
https://doi.org/10.3390/fermentation9020101
Pasotti, L., De Marchi, D., Casanova, M., Frusteri Chiacchiera, A., Cusella De Angelis, M. G., Calvio, C., & Magni, P. (2023). Design of a stable ethanologenic bacterial strain without heterologous plasmids and antibiotic resistance genes for efficient ethanol production from concentrated dairy waste. Biotechnology for Biofuels and Bioproducts, 16(1), 1-13.
https://doi.org/10.1186/s12896-017-0369-y
2022:
www.geniusjournals.org/index.php/emrp/article/view/2162 (2022 Sept. 22)
Bioreaktor a fermentor LAMBDA MINIFOR pro školy a univerzity
Pokusy s růstem bakterií mléčného kvašení: Vliv teploty na Lacticaseibacillus casei a Lactobacillus kefiri.
Během 65 dnů byly v anaerobních podmínkách (N2 do headspace a sparging) provozovány dva kontinuální (HRT = 5 dnů) míchací tankové fermentory LAMBDA MINIFOR, každý s pracovním objemem 1 litr (modifikace koncentrace laktátu/acetátu), inokulované kalem produkujícím kaproáty (rod Caproiciproducens (čeleď Ruminococcaceae)), s regulací teploty (30 °C, vestavěný IR ohřívač, sonda Mettler InPro 3253) a regulací pH (pH 5.5, NaOH 2M, HCl 0.5M) ) se čtyřmi peristaltickými čerpadly (přívod, odtok, báze a kyselina) a denním odběrem vzorků kapaliny pro analýzu karboxylátů a alkoholů.
Kontinuální kultura: 1 měsíc chemostat ve fotobioreaktoru LAMBDA MINIFOR PBR (1 L; 30 °C; 1 L/min vzduchu obohaceného o CO2 (0.5 %); 5 Hz, pH 8; bílé světlo) se Synechocystis sp. PCC 6803.
Behle, A., Dietsch, M., Goldschmidt, L., Murugathas, W., Berwanger, L.C., Burmester, J., Yao, L., Brandt, D., Busche, T., Kalinowski, J., Hudson, E.P., Ebenhöh, O., Axmann, I.M. & Machné, R. (2022). Manipulation of topoisomerase expression inhibits cell division but not growth and reveals a distinctive promoter structure in Synechocystis. Nucleic Acids Research, Volume 50, Issue 22, 9 December 2022, Pages 12790–12808.
https://doi.org/10.1093/nar/gkac1132
Biokatalytické řešení lupaninového racemátu v průmyslových odpadních vodách pomocí Pseudomonas putida LPK411 v laboratorním bioreaktoru LAMBDA MINIFOR 0.4L v batch provozu.
Parmaki, S., Esteves, T., Gonçalves, J.M.J. Catenacci, A., Malpei, F., Ferreira, F.C., Afonso C.A.M & Koutinas, M. (2022). Selective microbial resolution of lupanine racemate: Bioprocess development and the impact of carbon catabolite repression on industrial wastewater valorisation. Biomass Conv. Bioref. (2022).
https://doi.org/10.1007/s13399-022-03383-3
Pro uvolnění bioaktivních peptidů byl zředěný proteinový izolát Kiwicha (KPI) z mouky ze semen Amaranthus caudatus L. podroben enzymatické hydrolýze pomocí bioproteázy LA-660 za použití bioreaktoru LAMBDA MINIFOR s kontinuálním mícháním, kontrolou pH a teploty (pH 8; 50 °C).
Martinez-Lopez, A., Rivero-Pino, F., Villanueva, A., Toscano, R., Grao-Cruces, E., Marquez-Paradas, E., Martin, M.E., Montserrat-de la Paz, S. & Millan-Linaresa, M.C. (2022). Kiwicha (Amaranthus caudatus L.) protein hydrolysates reduce intestinal inflammation by modulating the NLRP3 inflammasome pathway. Food & Function 2022 Oct 21.
https://doi.org/10.1039/D2FO02177C
Escherichia coli (E. coli; E44Δ) mutantní kmen pro produkci velkého množství vezikul vnější membrány (OMV) ve fermentoru LAMBDA MINIFOR 7L
Allahghadry, T., Bojesen, A.M., Whitehead, B.J. and Antenucci, F. (2022). Clarification of large-volume bacterial cultures using a centrifuge-free protocol. J Appl Microbiol. Accepted Author Manuscript.
https://doi.org/10.1111/jam.15608
2021:
Pokusy s kapalnou fází (hydrolyzát hemicelulózy) pro výrobu xylitolu: Fermentace 250 ml detoxifikovaného hydrolyzátu byla provedena v 1L fermentoru (stolní laboratorní fermentor LAMBDA MINIFOR) a úprava pH (pH 5.0) za aerobních podmínek při 30 °C po dobu 60 h.
Shalsh, D., Nagimm, D., Alrheem, M.A. & Alrheem, S.A. (2021). Batch fermentation and Simultaneous Saccharification and Fermentation (SSF) processes by Meyerozyma Guilliermondii Strain F22 and Saccharomyces cerecvisae for xylitol and bioethanol co-production. Al-Qadisiyah Journal of Pure Science, 26(4), 80–94.
https://doi.org/10.29350/qjps.2021.26.4.1347
Růst, spotřeba glukózy a produkce etanolu kmene Saccharomyces cerevisiae LM v syntetickém bujónu byly modelovány pro nejdůležitější vnitřní vlastnosti.Byly použity litrové fermentory LAMBDA MINIFOR vybavené kondenzátorem studené vody na výstupním potrubí vzduchu (LAMBDA Instruments GmbH, Baar- Švýcarsko).
Kouamé, C., Loiseau, G., Grabulos, J., Boulanger, R. & Mestres, C. (2021). Development of a model for the alcoholic fermentation of cocoa beans by a Saccharomyces cerevisiae strain. International Journal of Food Microbiology, Volume 337, 2021, 108917, ISSN 0168-1605.
https://doi.org/10.1016/j.ijfoodmicro.2020.108917
Kontinuální kultivace sinic Synechocystis sp. PCC 6803 ve fotobioreaktoru LAMBDA MINIFOR 1L
Behle, A., Dietsch, M., Goldschmidt, L., Murugathas, W., Brandt, D., Busche, T., Kalinowski, J., Ebenhöh, O., Axmann, I. M. & Machné, R. (2021) Uncoupling of the Diurnal Growth Program by Artificial Genome Relaxation in Synechocystis sp. PCC 6803. bioRxiv 2021.07.26.453758.
https://doi.org/10.1101/2021.07.26.453758
Hydrolýza bílkovinného izolátu kiwicha (KPI) se provádí za kontinuálního míchání ve fermentoru-bioreaktoru LAMBDA MINIFOR za kontrolovaných podmínek pH a teploty: Bioproteáza LA-660 se přidává v poměru enzym/substrát = 0.3 AU/g proteinu (pH 8) po dobu 5, 10, 15, 30 a 60 min.
Paz, S. M. D. L., Martinez-Lopez, A., Villanueva-Lazo, A., Pedroche, J., Millan, F., & Millan-Linares, M. C. (2021). Identification and characterization of novel antioxidant protein hydrolysates from kiwicha (Amaranthus caudatus L.). Antioxidants, 10(5), 645.
https://doi.org/10.3390/antiox10050645
Biologická transformace biomasy bílého čiroku probíhala za provozních podmínek podobných procesu MixAlco v bioreaktoru LAMBDA MINIFOR.
Shalsh, F.J., Alrazzaq, N.A., Nagimm D.K., Alrheem, M.A., Alrheem S.A. & Abd-alalah, K. (2021). Bioconversion of white sorghum biomass using MixAlco fermentation process. DYSONA – Applied Science. 2021(2), 21-27. ISSN 2708-6283.
https://doi.org/10.30493/DAS.2021.248966
2020:
Různé kmeny kvasinek byly kultivovány ve fermentoru LAMBDA MINIFOR o objemu 0.4 L za účelem studia metabolického cyklu a metabolické dráhy: A) 200 ml dávka: B) hladovění 6 h; C) kontinuální kultivace: rychlost ředění 0.082 1/h.
J. Feltham, S. Xi, S. Murray, M. Wouters, J. Urdiain-Arraiza, C. George, A. Townley, E. Roberts, R. Fisher, S. Liberatori, S. Mohammed, B. Kessler & J. Mellor. (2020). Transcriptional changes are regulated by metabolic pathway dynamics but decoupled from protein levels. bioRxiv 833921.
https://doi.org/10.1101/833921
Bioreaktor LAMBDA MINIFOR (vybavený 2 peristaltickými čerpadly (slinné a permeátové čerpadlo), horním míchadlem, redoxně-teplotně-pH sondou, jednotkou pro regulaci teploty a modulem s ponořenou membránou z dutých vláken) se používá jako bachorový membránový bioreaktor k výrobě těkavých mastných kyselin (VFA) z rostlinných zbytků (lignocelulózové biomasy) napodobením trávicího systému přežvýkavců.
Nguyen, A.Q., Nguyen, L.N., Abu Hasan Johir, M., Ngo, H-H., Chaves, A.V. & Nghiem, L.D. (2020) Derivation of volatile fatty acid from crop residues digestion using a rumen membrane bioreactor: a feasibility study. Bioresource Technology 2020.
https://doi.org/10.1016/j.biortech.2020.123571
Experimenty s enzymovou hydrolýzou byly prováděny v laboratorním míchaném bioreaktoru LAMBDA MINIFOR. Předupravený odpad z vinných výhonků byl delignifikován chloritanem sodným za účelem odstranění ligninu a poté enzymaticky hydrolyzován pomocí nových typů enzymů (celulázy z Trichoderma reesei a b-glukosidázy).
Eniko Kovacs, Daniela Alexandra Scurtu, Lacrimioara Senila, Oana Cadar, Diana Elena Dumitras & Cecilia Roman (2020). Green Protocols for the Isolation of Carbohydrates from Vineyard Vine-Shoot Waste. Analytical Letters.
https://doi.org/10.1080/00032719.2020.1721001
Bioreaktor LAMBDA MINIFOR používaný k biotechnologické výrobě kyseliny itakonové z glukózy pomocí houbového kmene Aspergillus terreus: 1.8 L média se 120 g/L glukózy jako substrátu, vsádkový režim, aerob: aerace 2 L/min (STP) = 6.5 mg/L inital DO, 37 °C, míchání 2 Hz, pH 3).
Nemestóthy, N., Komáromy, P., Bakonyi, P. et al. (2020). Carbohydrate to Itaconic Acid Conversion by Aspergillus terreus and the Evaluation of Process Monitoring Based on the Measurement of CO2 Waste and Biomass. Valorization 2020.
https://doi.org/10.1007/s12649-019-00729-3
2019:
LAMBDA MINIFOR bioreactor used in turbidostat experiments with recombinant cells in continuous culture operation mode
Pasotti, L., Bellato, M., Politi, N., Casanova, M., ucca, S., Gabriella, M., De Angelis, C. & Magni, P. (2019). A synthetic close-loop controller circuit for the regulation of an extracellular molecule by engineered bacteria. IEEE Trans Biomed Circuits Syst. 2019 Feb; 13(1):248-258.
https://doi.org/10.1109/TBCAS.2018.2883350
Optimalizace pH pro aerobní výrobu kyseliny itakonové katalyzovanou Aspergillus terreus v bioreaktoru LAMBDA MINIFOR: Várka, pracovní objem 1.8 L, médium s glukózovým substrátem 120 g/L, 37 °C, pH 3 - pH 2.5 - pH 4 - pH 3 - pH 2.5, míchadlo 2 Hz, aerace 1.5 L(STP)/min.
Komáromy, K., Bakonyi, P., Kucska, A., Tóth, G., Gubicza, L., Bélafi-Bakó, K. & Nemestóthy, N. (2019). Optimized pH and Its Control Strategy Lead to Enhanced Itaconic Acid Fermentation by Aspergillus terreus on Glucose Substrate. Fermentation 2019, 5(2), 31
https://doi.org/10.3390/fermentation5020031
Produkce rhamnolipidu pomocí Pseudomonasy aeruginosy v LAMBDA MINIFOR 7L fermentoru. (30 °C, pH 6.5, batch, 120 h) pro čištění sekundárního metabolitu.
Faqri, A. F., Hayder, N.H. & Hashim, A.J. (2019). Lab-scale production of Rhamnolipid by Pseudomonas Aeruginosa A3 and study its synergistic effect with certain antibiotics against some pathogenic bacteria. Iraqi Journal of Agricultural Sciences –2019:50(5):1290-1301.
https://doi.org/10.13140/RG.2.2.10802.35520
2018:
Byla vyvinuta rozsáhlá metoda výroby pro-siRNA v bioreaktoru LAMBDA MINIFOR pro výrobu pro-siRNA s vysokým výtěžkem.
Kaur, G., Cheung, H. C., Xu, W., Wong, J. V., Chan, F. F., Li, Y., McReynolds, L. & Huang, L. (2018). Milligram scale production of potent recombinant small interfering RNAs in Escherichia coli. Biotechnology and Bioengineering, 115(9), 2280-2291.
https://doi.org/10.1002/bit.26740
Pro výrobu bioetanolu byl za optimalizovaných podmínek použit stolní laboratorní fermentor LAMBDA MINIFOR: cerevisiae (inokulace 2 % (v/v), OD = 0.5, 1.5 × 10e8 CFU/ml) v aerobní fermentaci po dobu 24 h při 30 °C, poté v anaerobních podmínkách po dobu 70 h při 30 °C.
Hayder, N. H., Flayeh, H. M., & Ahmed, A. W. (2018). Optimization of bioethanol production from biodegradable municipal solid waste using response surface methodology (RSM). Journal of Engineering and Sustainable Development, 22(1), 47-64.
https://www.iasj.net/iasj/download/28dcbea4ab5f5ba8 (2024 Feb. 05)
2017:
Srovnání experimentální a teoretické produkce bioplynu. Bioreaktor LAMBDA MINIFOR naplněný 2 litry inokula byl inkubován anaerobně při 35 °C po dobu 1 měsíce.
El Asri, O., & Afilal, M. E. (2018). Comparison of the experimental and theoretical production of biogas by monosaccharides, disaccharides, and amino acids. International Journal of Environmental Science and Technology, 15(9), 1957-1966.
https://doi.org/10.1007/s13762-017-1570-1
Studium metabolismu izolovaných buněk kozlíku lékařského (Valerianella locusta (L). Laterr.) při hladovění cukrem za podmínek stresu O2 s použitím glukózy značené 13C [U-13C6] ve stolním laboratorním bioreaktoru LAMBDA MINIFOR (tma, 250 ml, pH 5.8, 18 °C, provzdušňování 10 L/h).
Victor, B. M. M., Ampofo-Asiama, J., Hertog, M., Geeraerd, A. H., & Nicolai, B. M. (2017). Metabolic profiling reveals a coordinated response of isolated lamb's (Valerianella locusta, L.) lettuce cells to sugar starvation and low oxygen stress. Postharvest Biology and Technology, 126, 23-33.
https://doi.org/10.1016/j.postharvbio.2016.12.004
Fermentory LAMBDA MINIFOR používané jako kontinuální anaerobní průtokové míchané fermentory (CSTR) pro anaerobní rozklad tuhého organického odpadu.
Nakasima-López, M., Taboada-González, P., Aguilar-Virgen, Q., & Velázquez-Limón, N. (2017). Adaptación de inóculos durante el arranque de la digestión anaerobia con residuos sólidos orgánicos. Información tecnológica, 28(1), 199-208.
https://dx.doi.org/10.4067/S0718-07642017000100020
V bioreaktoru LAMBDA MINIFOR byl studován vliv různých teplot na hladovění cukrem u buněk izolovaných z čerstvé listové zeleniny.
Mbong, V. B. M., Ampofo-Asiama, J., Hertog, M. L., Geeraerd, A. H., & Nicolai, B. M. (2017). The effect of temperature on the metabolic response of lamb’s lettuce (Valerianella locusta,(L), Laterr.) cells to sugar starvation. Postharvest Biology and Technology, 125, 1-12.
https://doi.org/10.1016/j.postharvbio.2016.10.013
Bioreaktor LAMBDA MINIFOR pro výrobu CB.Hep-1 mAb pomocí myší hybridomové buněčné kultury v bezproteinovém médiu
Valdés, R., Aragón, H., González, M., Hernández, D., Geada, D., Goitizolo, D., Ferro, W., Pérez, A., García, J., Masforrol, Y, Aguilar, P., Márquez, G., LaO, M., González, T., Calvo, Y., Hernández, A., Menéndez, G. & Tamayo, A. (2017). Mouse Hybridoma Cell Culture in a Protein-Free Medium Using a Bio-Mimicking Fish-Tail Disc Stirred Bioreactor. BioProcessing Journal, 16(1).
https://doi.org/10.12665/J161.Valdes
2016:
Robustní výroba celulózového etanolu z cukrové třtiny pomocí Saccharomyces cerevisiae ATCC 20602 v laboratorním bioreaktoru LAMBDA MINIFOR za aerobních a anaerobních podmínek s kontrolovaným měřením redoxního potenciálu.
Jabasingh, S. A., Lalith, D., Prabhu, M. A., Yimam, A., & Zewdu, T. (2016). Catalytic conversion of sugarcane bagasse to cellulosic ethanol: TiO2 coupled nanocellulose as an effective hydrolysis enhancer. Carbohydrate polymers, 136, 700-709.
https://doi.org/10.1016/j.carbpol.2015.09.098
2015:
Bioreaktorový systém LAMBDA MINIFOR jako systém umělých úst pro růst biofilmů.
LA BOCA ARTIFICIAL DE DENTAID UNA REVOLUCIÓN EN INVESTIGACIÓN BUCODENTAL
DENTAID EXPERTISE, PUBLICACIÓN PARA PROFESIONALES DE LA ODONTOLOGÍA, NÚM. 18.
https://aprenderly.com/doc/3463742/la-boca-artificial-de-dentaid-una-revolución-en-investiga…?page=5 (2024 Feb. 05)
S. pyogenes Cas9 protein was expressed in E. coli using a computer-controlled LAMBDA MINIFOR 3L bioreactor in batch mode followed by exponential feeding
Ménoret, S., De Cian, A., Tesson, L., Remy, S., Usal, C., Boulé, J. B., Boix, C., Fontanière, S., Crénéguy, A., Nguyen, T.H., Brusselle, L., Thinard, R., Gauguier, D., Concordet, J.-P., Cherifi, Y., Fraichard, A., Giovannangeli, C. & Anegon, I. (2015). Homology-directed repair in rodent zygotes using Cas9 and TALEN engineered proteins. Scientific reports, 5(1), 14410.
https://doi.org/10.1038/srep14410
Fermentace upravených mikroorganismů v laboratorním bioreaktoru LAMBDA MINIFOR pro účinnou přeměnu laktózy na etanol
Pasotti, L., Zucca, S., Casanova, M., Massaiu, I., Mazzini, G., Micoli, G., Calvio, C., Cusella de Angelis, M.G. & Magni, P. (2015, August). Methods for genetic optimization of biocatalysts for biofuel production from dairy waste through synthetic biology. In 2015 37th Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC) (pp. 953-956). IEEE.
https://doi.org/10.1109/EMBC.2015.7318521
Six-species flow cell biofilm model was developed by culturing bacteria in LAMBDA MINIFOR bioreactor to evaluate the biofilm development under flow and shear conditions
Salli, K. M., & Ouwehand, A. C. (2015). The use of in vitro model systems to study dental biofilms associated with caries: a short review. Journal of oral microbiology, 7(1), 26149.
https://doi.org/10.3402/jom.v7.26149
Quantification of ribosomal proteins (RPs) from Yeast cells cultured in LAMBDA MINIFOR bioreactor and mouse embryonic stem cells (ESC) to study the core RPs stoichiometry
Slavov, N., Semrau, S., Airoldi, E., Budnik, B., & van Oudenaarden, A. (2015). Differential stoichiometry among core ribosomal proteins. Cell reports, 13(5), 865-873.
https://doi.org/10.1016/j.celrep.2015.09.056
Harvard University, USA; Broad Institute of MIT and Harvard, USA and Hubrecht Institute, Netherlands.
2014:
Cultivation of microalgae (Chlorella vulgaris Beyerinck) in laboratory bioreactor LAMBDA MINIFOR
Heitur, H. (2014). Mikrovetika Chlorella vulgaris Beyerincki kasvatamine CO2 sidumise eesmärgil (Master's thesis).
https://hdl.handle.net/10492/1842 (2024 Feb. 05)
Eesti Maaülikool (Estonian University of Life Sciences), Estonia.
Growing yeast cultures (DBY12007) in the LAMBDA MINIFOR fermenter at steady state to study the aerobic glycolysis and energy flux
Slavov, N., Budnik, B. A., Schwab, D., Airoldi, E. M., & van Oudenaarden, A. (2014). Constant growth rate can be supported by decreasing energy flux and increasing aerobic glycolysis. Cell reports, 7(3), 705-714.
https://doi.org/10.1016/j.celrep.2014.03.057
Massachusetts Institute of Technology, USA; Harvard University, USA; Hubrecht Institute, Royal Netherlands Academy of Arts and Sciences and University Medical Center Utrecht, Netherlands and Princeton University, USA.
Selective and non-selective batch fermentation of date extract using Saccharomyces cerevisiae (commercial strain used in bakeries (wild strain), glucose selective strains ATCC 36858 and ATCC 36859) studied in LAMBDA MINIFOR fermentor
Putra, M. D., Abasaeed, A. E., Zeinelabdeen, M. A., Gaily, M. H., & Sulieman, A. K. (2014, April). Selective fermentation of pitted dates by S. cerevisiae for the production of concentrated fructose syrups and ethanol. In Journal of Physics: Conference Series (Vol. 495, No. 1, p. 012034). IOP Publishing.
https://doi.org/10.1088/1742-6596/495/1/012034
King Saud University, Chemical Engineering Department, Saudi Arabia
The metabolic stress response of tomato cell culture (Lycopersicum esculentum) to low oxygen studied using LAMBDA MINIFOR Bioreactor
Ampofo‐Asiama, J., Baiye, V. M. M., Hertog, M. L. A. T. M., Waelkens, E., Geeraerd, A. H., & Nicolai, B. M. (2014). The metabolic response of cultured tomato cells to low oxygen stress. Plant Biology, 16(3), 594-606.
https://doi.org/10.1111/plb.12094
KU Leuven, Belgium; Flanders Centre of Postharvest Technology (VCBT), Leuven, Belgium.
LAMBDA MINIFOR bioreactor to grow the oral bacteria (Streptococcus oralis, Actinomyces naeslundii, Veillonella parvula, Fusobacterium nucleatum, Aggregatibacter actinomycetemcomitans and Porphyromonas gingivalis) under planktonic conditions
Blanc, V., Isabal, S., Sanchez, M. C., Llama‐Palacios, A., Herrera, D., Sanz, M., & León, R. (2014). Characterization and application of a flow system for in vitro multispecies oral biofilm formation. Journal of Periodontal Research, 49(3), 323-332.
https://doi.org/10.1111/jre.12110
DENTAID S. L., Cerdanyola del Vallès, Spain; ETEP Research Group, University Complutense of Madrid, Spain.
LAMBDA MINIFOR Bioreactor used for recombinant protein (Chemokines) expression in E. coli
Kramp, B. (2014). Establishing the interaction between the CC chemokine ligand 5 and the receptors CCR1 and CCR (Doctoral dissertation, Aachen, Techn. Hochsch., Diss., 2013).
https://core.ac.uk/download/pdf/36589112.pdf (2024 Feb. 05)
RWTH Aachen, Germany.
Optimalizace média a kinetika růstu S. marcescens byly studovány ve stolním bioreaktoru LAMBDA MINIFOR 7L Advanced Kit: dávková kultivace při 30 °C, aerace 3 L/min, míchání 4 Hz, pH 6, polypropylenglykol jako protipěnidlo.
Mohammed, S. J. (2014). Optimization Of medium Composition for increasing prodigiosin production by local isolate of Serratia marcescens. Doctoral thesis, Al-Khwarizmi College of engineering, Department of Biochemical engineering, University of Baghdad.
https://doi.org/10.13140/RG.2.2.18638.7968
2013:
Development of biofilm model (S. oralis, A. naeslundii, V. parvula, F. nucleatum, A. actinomycetemcomitans and P. gingivalis) in continuous flow in a LAMBDA MINIFOR 0.4L bioreactor.
Soto, I. S. (2013). Desarrollo del modelo de boca artificial en flujo continuo en el biorreactor Lambda Minifor. Universidad Complutense de Madrid Master en Ciencias Odontológicas.
https://docta.ucm.es/rest/api/core/bitstreams/39d8318b-a49b-4cb3-a164-e4faab18f52b/content (2024 Feb. 05)
Recombinant expression of the Met-CCL5, protease resistant CXCL12 (S4V) and F1-CX3CL1 in E. coli using LAMBDA MINIFOR fermenter/bioreactor to study their role in Cardiovascular disease (CVD)
Projahn, D. (2013). Generation, function and therapeutic application of chemotactic cytokines in cardiovascular diseases (Doctoral dissertation, Aachen, Techn. Hochsch., Diss., 2013).
https://publications.rwth-aachen.de/record/229207/files/4840.pdf (2024 Feb. 05)
RWTH Aachen, Germany.
Expression of Caf1 protein using Escherichia coli strain in LAMBDA MINIFOR fermentor to study mammalian cell adhesion, shape and number of focal adhesion
Machado Roque, A. I. (2013). Protein scaffolds for cell culture (Doctoral dissertation, Newcastle University).
URI: https://hdl.handle.net/10443/1843 (2024 Feb. 05)
Newcastle University, UK.
Controlled growth of Staphylococcus aureus under various concentrations of BAC (benzalkonium chloride) in LAMBDA MINIFOR fermentor
Cervinkova, D., Babak, V., Marosevic, D., Kubikova, I., & Jaglic, Z. (2013). The role of the qacA gene in mediating resistance to quaternary ammonium compounds. Microbial Drug Resistance, 19(3), 160-167.
https://doi.org/10.1089/mdr.2012.0154
Veterinary Research Institute, Brno, Czech Republic.
2012:
Efektivní výroba biobutanolu ze zemědělského odpadu (křídlatka obrovská, seno) pomocí stolního laboratorního fermentoru LAMBDA MINIFOR
Mezule, L., Tihomirova, K., Nescerecka, A., & Juhna, T. (2012). Biobutanol production from agricultural waste: A simple approach for pre-treatment and hydrolysis. Latvian Journal of Chemistry, 51(4), 407.
https://doi.org/10.2478/v10161-012-0028-5
2011:
Bioethanol production using Yeast (S. cerevisiae) in LAMBDA MINIFOR fermenter
Burešová, I., & Hřivna, L. (2011). Effect of wheat gluten proteins on bioethanol yield from grain. Applied Energy, 88(4), 1205-1210.
https://doi.org/10.1016/j.apenergy.2010.10.036
2010:
Anaerobic fermentation of the glucose component in dates extract by yeast Saccharomyces cerevisiae
Gaily, M. H., Elhassan, B. M., Abasaeed, A. E., & Al-Zahrani, S. M. (2010). A direct process for the production of high fructose syrups from dates extracts. International Journal of Food Engineering, 6(3).
https://doi.org/10.2202/1556-3758.1879
King Saud University, Saudi Arabia; University of Khartoum, Sudan
Study of the potential of tree tobacco stems (Nicotiana Glauca r. Grah.) as a bioethanol feedstock with the LAMBDA MINIFOR fermenter
Sánchez, F., Curt, M. D., Barreiro, M., Fernández, J., Agüera, J. M., Uceda, M., & Zaragoza, G. (2010). TREE TOBACCO (NICOTIANA GLAUCA R. GRAH.) STEMS AS A BIOETHANOL FEEDSTOCK. 18th European Biomass Conference and Exhibition, 3-7 May 2010, Lyon, France.
Dpt. Producción Vegetal: Botánica y Protección Vegetal. Universidad Politécnica de Madrid (UPM), Madrid, Spain
2009:
Stanovení alkoholového potenciálu necelulózových sacharidů z opuncií fermentací s kvasinkami Saccharomyces cerevisiae (komerční kmeny)
Sánchez, F., Curt, M. D., Fernández, J., Agüera, J. M., Uceda, M., & Zaragoza, G. (2009). Bioethanol production from prickly pear (Opuntia ficus-indica (L.) Mill.) cladodes. In Proc. 17th European Biomass Conference. Pub. ETA-Florence Renewable Energies & WIP-Renewable Energies. ISBN (pp. 978-88).
Dpt. Producción Vegetal: Botánica y Protección Vegetal. Universidad Politécnica de Madrid (UPM), Madrid, Spain
2007:
Anaerobní exprese s použitím LAMBDA MINIFOR
Park, M. O., Mizutani, T., & Jones, P. R. (2007). Glyceraldehyde-3-phosphate ferredoxin oxidoreductase from Methanococcus maripaludis. Journal of bacteriology, 189(20), 7281-7289.
Prodáváte / dodáváte přístroje i do USA?
Ano, dodáváme naše přístroje přepravními službami do USA s možností online sledování.
Jaká je dostupnost produktu?
Máme přístroje na skladě. Přístroje je třeba upravit podle požadavků zákazníka a před odesláním provést test kontroly kvality.
Jaká záruční doba je nabízena?
Nabízíme dvouletou záruku na MINIFOR fermentor / bioreaktor a pětiletou záruku na peristaltická čerpadla PRECIFLOW & MULTIFLOW.
Lze použít fermentor jak pro buněčné kultury, tak pro kvasinky?
Ano, MINIFOR fermentor a bioreaktor lze použít pro buněčné kultury i kvasinky (více informací na www.fermentor.net/applications).
Existuje možnost odebrání či přidání sond do fermentační nádoby?
Ano, MINIFOR fermentor a její nádoba má volné porty pro další sondy (senzory).
Díky nabídce více portů a dalšímu efektivnímu řešení může být dosaženo konfigurace až 16 či 22 klasických portů.
Je zařízení vhodné pro použití čisté / smíšené kultury?
Ano, MINIFOR je vhodný pro čistou i smíšenou kulturu. Míchadlo je silné a lze jej snadno přizpůsobit typům kultur a pracovním objemům.
Proč je MINIFOR dokonale vhodný pro paralelní procesy?
Každá kontrolní jednotka zůstává nezávislá, protože je vybavena svým ovládacím panelem a displejem, který zobrazuje hodnoty parametrů. Všechny parametry jsou regulovány lokálně uvnitř každé jednotky fermentoru a bioreaktoru. Toto umožňuje rychlou a přesnou regulaci parametrů. Výhodou je, že v případě problémů s jednou jednotkou budou ostatní jednotky stále fungovat.
Jak důležité je zpomalení regulace parametrů při paralelním zapojení 12 bioreaktorů?
Je třeba vzít v úvahu tento důležitý aspekt - který však nehraje roli v paralelním zapojení LAMBDA MINIFOR fermentorů, protože každý fermentor MINIFOR je vybaven vlastní regulační jednotkou, která lokálně měří a řídí všechny parametry. V důsledku toho není kvalita měření a regulace ovlivněna dlouhými časy přenosu a mrtvými časy v regulaci.
Kolik místa je zapotřebí pro jednotku MINIFOR?
Potřebné místo: přibližně list papíru
Rozměry: 22 cm x 38 cm x 40 cm (Š x V x H)
 Váhový modul pro kontinuální kultury
Zobrazit více
Váhový modul pro kontinuální kultury
Zobrazit více
 LAMBDA REDOX
měřič Redox potenciálu (mV)
Zobrazit více
LAMBDA REDOX
měřič Redox potenciálu (mV)
Zobrazit více
 MINI-4-GAS
Zobrazit více
MINI-4-GAS
Zobrazit více
 Automatický odpěňovač
Zobrazit více
Automatický odpěňovač
Zobrazit více
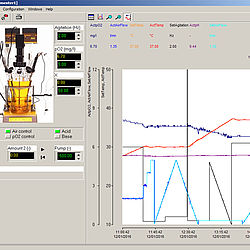 Fermentační software FNet
Zobrazit více
Fermentační software FNet
Zobrazit více
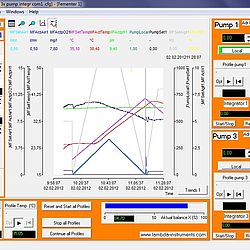 SIAM pokročilý program pro fermentace
fermentační program
Zobrazit více
SIAM pokročilý program pro fermentace
fermentační program
Zobrazit více
 MINI-4-GAS softwarový modul
Zobrazit více
MINI-4-GAS softwarový modul
Zobrazit více
 LAMBDA OXYMETER
Měří koncentraci O2 v odchozím plynu
Zobrazit více
LAMBDA OXYMETER
Měří koncentraci O2 v odchozím plynu
Zobrazit více
 LAMBDA CARBOMETER
Měří koncentraci CO2 v odchozím plynu
Zobrazit více
LAMBDA CARBOMETER
Měří koncentraci CO2 v odchozím plynu
Zobrazit více
 LAMBDA METHAMETER
měření koncentrace CH4 (0-100 %)
Zobrazit více
LAMBDA METHAMETER
měření koncentrace CH4 (0-100 %)
Zobrazit více
 PRECIFLOW pumpa-doplňkový set
PRECIFLOW peristaltická pumpa, reagenční láhev s kanylou, uchycením, filtrem a hadičkou
Zobrazit více
PRECIFLOW pumpa-doplňkový set
PRECIFLOW peristaltická pumpa, reagenční láhev s kanylou, uchycením, filtrem a hadičkou
Zobrazit více
 MULTIFLOW pumpa-doplňkový set
MULTIFLOW peristaltická pumpa, reagenční láhev s kanylou, uchycením, filtrem a hadičkou
Zobrazit více
MULTIFLOW pumpa-doplňkový set
MULTIFLOW peristaltická pumpa, reagenční láhev s kanylou, uchycením, filtrem a hadičkou
Zobrazit více
