Bioreaktor - Laborfermenter
Bioreaktor - Laborfermenter
Durch Innovationen zu einem Laborfermenter und Bioreaktor zum halben Preis. LAMBDA setzt neue Massstäbe in der Laborfermentation und für Zellkulturen:
LAMBDA MINIFOR Bioreaktor und Laborfermenter
LAMBDA MINIFOR ist ein Laborfermenter und Benchtop-Bioreaktor für Arbeitsvolumen von 35 ml bis 6 Liter. Alle wichtigen Parameter der Kultur werden gemessen und geregelt. Die Bedienung ist logisch und einfach aufgebaut. Das Kulturgefäss, die Elektroden und der Zubehör, der mit dem Reaktormedium in Berührung kommt, sind einfach autoklavierbar.

Minimale Stellfläche auch für Parallelreaktoren
Der Laborfermenter und Bioreaktor MINIFOR nimmt nur eine minimale Tischfläche in Anspruch (etwa ein A4 Blatt).
Beliebig viele Bioreaktoreinheiten können als Parallelreaktor zusammengestellt werden und so mit minimalem Bedienungsaufwand mehrere Versuche parallel durchgeführt werden.

Das ist besonders vorteilhaft für die Optimierung der Wachstumsparameter (pH, pO2, Temperatur), Medienoptimierung (C- und N-Quelle, Spurenelemente, Aminosäuren usw.) von Biotransformationen und Bioreaktionen und für den Einsatz im regulären Screening.
Bedienung des Bioreaktors, Fernsteuerung und Datenspeicherung
Jede Bioreaktoreinheit wird durch einen eigenen Mikroprozessor kontrolliert und kann individuell über die Tastatur am Bioreaktor bedient werden.
Die Soll- und Ist-Werte aller Parameter sind gleichzeitig auf der Anzeige sichtbar (kein Umblättern oder Scrolling).
Sie können den Bioreaktor LAMBDA MINIFOR optional auch über Ihren PC bedienen.
Mit der Automation-Software SIAM und der Fermentationssoftware FNet werden ein einzelner Bioreaktor MINIFOR oder das Parallelreaktorsystem von einem PC gesteuert, sämtliche Daten gespeichert, bearbeitet und übersichtlich dargestellt.
Innovationen für ein ausgezeichnetes Preis-Leistungsverhältnis
Für das ausgezeichnete Preis-Leistungsverhältnis ist der Bioreaktor und Laborfermenter LAMBDA MINIFOR mit folgenden Innovationen bestückt:
Einfach austauschbare Kulturgefässe für den Bioreaktor & Laborfermenter
- Die Kulturgefässe (0.3, 0.4, 1, 3 und 7L) sind mit Glasschraubverbindungen mit Multipunkt-Dichtungen aus Silikon versehen und können zusammen mit den Sonden ganz einfach im Autoklaven sterilisiert werden. Die Silikondichtungen lassen sich sehr einfach montieren. Der Fermentor MINIFOR ist dadurch in Rekordzeit einsatzbereit und garantiert eine anhaltende Sterilität und eine einfache Sterilarbeit nach der Inokulation.
- Anstelle des üblichen Propellerrührers (mit der kontaminationsanfälligen mechanischen Kupplung) oder eines Magnetrührers wurde beim MINIFOR ein Vibromischer eingesetzt. Seine Bewegung verursacht ein intensives Durchmischen und die optimale Begasung des Mediums (kein Luftstau) bei zugleich niedrigen Scherkräften. Die biomimetischen elastischen FiSH-TAIL-Mischplatten garantieren eine maximale Mischeffizienz und völlig ohne Schnittkanten.
- Zur Erwärmung und Temperaturkontrolle dient ein Infrarot-Strahler mit Goldschicht-Reflektor, der unter dem Glasgefäss installiert ist. Die Wärmestrahlung wird durch das Medium sanft und regelmässig absorbiert. Damit wird die lokale Überhitzung der Kultur an der Oberfläche von Heizstäben oder Heizmatten vermieden und hohe Kosten wie bei Doppelmantelgefässen mit Wasserkreislauf eingespart. Die freie Oberfläche des Gefässes erlaubt eine einfache Kühlung des Mediums durch die Raumluft.
- Durch die moderne Mikroprozessortechnologie kann die gesamte Elektronik unter der Frontplatte des Laborfermenters/Bioreaktors untergebracht werden. MINIFOR ist dadurch im Konkurrenzvergleich einzigartig kompakt, ohne an Parameteroptionen einzubüssen.
- Anstelle eines teuren Reaktordeckels aus rostfreiem Stahl wurde für MINIFOR ein hochwertiger Kunststoff verwendet (durch eine Silikonkappe von der Kultur getrennt). Die Reaktorkonstruktion sieht ein Minimum an Verbrauchsmaterial vor. Im Gegensatz zu herkömmlichen Reaktordeckeln sind bei MINIFOR keine zeitaufwendig zu ersetzende O-Ringe oder teures Ersatzmaterial eingebaut.
Abmessung: 22 x 40 x 38 cm (B x T x H)
Anzeige: LCD 4 x 40 Ziffern mit Hintergrundbeleuchtung
Fermentergefäss: Austauschbare Gefässtypen: 0.3L, 0.4L, 1L, 3L, 7L; Pyrex-Glasgefäss mit 6 bis 10 Gewindestutzen für Multi-Anschlüsse
Temperaturkontrolle: Hocheffizienter 150 W IR-Strahler (Infrarot-Strahler) Wärmequelle mit vergoldetem parabolischem Spiegel
Regelung: Ab 5 °C über der Raumtemperatur bis 70 °C
Auflösung: Ab 0 °C bis 99.9 °C in Schritten von 0.1 °C
Genauigkeit: +/- 0.2 °C (0 °C bis 60 °C)
Thermoelement: Pt100 (in der Glaselektrode der pH-Sonde eingebaut)
pH-Kontrolle: Sterilisierbare pH-Elektrode, pH 0-14 mit automatischer Temperaturkorrektur, Zwei-Punkt-Kalibrierung, halbautomatische Eichung und Variopin Steckverbinder
Auflösung: 0.01 pH Einheiten (elektr. Anzeige)
Genauigkeit: +/- 0.02 pH Einheiten (elektr. Anzeige)
pO2 Messung und Regelung: Sterilisierbare Sauerstoff-Elektrode (Clark Typ) mit schneller Ansprechzeit, automatischer Temperaturkorrektur, Zwei-Punkt-Kalibrierung, halbautomatische Eichung, Regler für gelösten Sauerstoff (DO) mit Steuerung durch die Belüftungsrate
Auflösung: 0 - 25 mg Sauerstoff/Liter, in 0.1 mg/L Schritten
Luftdurchflussmessung: 0 - 5 L/min in 0.01 L/min Schritten, präziser Massenflussregler, Linearität+/- 3%, Reproduzierbarkeit +/- 0.5%
Regulierung: Proportionalventil gesteuert durch Mikroprozessor
Begasung: 0.05 – 0.2 MPa (0.5 - 2 atm)
Rührung: 50 W Vibrationmischer 0 Hz - 20 Hz ( entsprechen 0 - 1200 rpm) in 0.1 Hz Schritten (6 rpm), mit 1 oder mehreren Mischplatten (Anzahl und Beschaffung wählbar); Sterilitätskapazität ähnlich jener einer Magnetkupplung
Wählbarer Parameter: Automatische Antischaumkontrolle, Gewichtskontrolle für den Chemostaten, pCO2, REDOX-Potential, Leitfähigkeit, optische Dichte oder anderer Parameter mit 0 - 10 V oder 0 - 20 mA Ausgang
Ernteeinrichtung-Probenahme: Ein grosser Viereranschluss für Probenahmen (Medium, Zellen) und Zugaben (Inokulation, Antischaum, Extrafeeds, Fütterungsmedium, Abernte, Korrekturflüssigkeiten für pH, …), Septum (Inokulation, Vitaminzugaben, …), zusätzliche Doppelanschlüsse sind erhältlich
Pumpenanschluss: Frei wählbare Anzahl LAMBDA Schlauchpumpen (PRECIFLOW, MULTIFLOW, HIFLOW, MAXIFLOW, MEGAFLOW) mit Geschwindigkeitsansteuerung zwischen 0 und 100 % als Stellglied für die Parameterkontrolle (z.B. Säure- und Basepumpen für die pHRegelung)
Gasflusskontrolle: Ein eingebauter MASSFLOW 0 – 5 L/min, einstellbar in 10 ml/min Schritten. Optional frei wählbare Anzahl MASSFLOW 5000 (für 0 – 5L/min) und MASSFLOW 500 (für 0 – 500 ml/min) für Einzelgase (N2, O2, Luft, CO2 ,…); MINI-4-GAS für Gasgemische basierend auf Flussraten und/oder Parameter-Sollwerten
Betriebstemperatur: 0 – 40 °C
Relative Betriebsfeuchtigkeit: 0 - 90 % rel. Luftfeuchtigkeit, nicht kondensierend
Gewicht: 7.5 kg
Fernsteuerung und Datenauswertung, PLS: Fermentationssoftware FNet (bis zu 6 MINIFOR Fermenter) oder Automationssoftware SIAM (höhere Kapazitäten), Laptop
- EN - LAMBDA MINIFOR Laboratory Fermenter-Bioreactor LEAFLET (pdf)
- EN - 20 innovations of LAMBDA MINIFOR laboratory-scale bioreactors — Overview and Benefits (pdf)
- EN - LAMBDA MINIFOR laboratory fermenter and bench-top bioreactor at universities and highschools (pdf)
- EN - Operation manual: MINIFOR lab fermentor-bioreactor (pdf)
- EN - Infographics: Overview of innovations in MINIFOR lab fermenter and bioreactor (pdf)
- EN - Quick overview of MINIFOR bioreactor vessels with connections, probes & tubing lines (pdf)
- EN - Peltier electronic cooling loop for Minifor fermentor (pdf)
- EN - PUMP-FLOW INTEGRATOR replaces the need for optical density measurements in fermenters and bioreactors (pdf)
- EN - REDOX potential measurement for MINIFOR laboratory fermentor (pdf)
- EN - MINI-4-GAS, the automatic gas mixing module (pdf)
- EN - How to compare the cost and real value of a laboratory fermentor? (pdf)
- EN - Solitary teamplayer in parallel processes - LAMBDA MINIFOR laboratory fermenter and bioreactor (pdf)
- DE - UNI _ LAMBDA MINIFOR Laborfermenter und Tischbioreaktor an Hochschulen (pdf)
- DE - Montageanleitung _ Kurzübersicht der Bioreaktorgefässe LAMBDA MINIFOR mit Anschlüssen, Sonden und Schlauchlinien (pdf)
- DE - Broschüre _ MINIFOR Laborfermenter Bioreaktor (pdf)
- DE - Parallelreaktor _ LAMBDA MINIFOR Laborfermenter Bioreaktor der Einzelgänger im Parallelsystem (pdf)
- DE - Bedienungsanleitung _ LAMBDA MINIFOR Labor-Tischfermenter und Bioreaktor (pdf)
- DE - LAMBDA MINIFOR Laborfermenter und Bioreaktor - Innovationsuebersicht und Vorteile (pdf)
- FR - MINIFOR - fermenteur de laboratoire (pdf)
- FR - Installation de cuve LAMBDA MINIFOR (pdf)
- FR - LAMBDA MINIFOR Start-Up Kit - mode d'emploie (pdf)
- FR - LAMBDA MINIFOR fermenteur / bioreacteur - Resume des innovations et avantages (pdf)
- FR - LAMBDA MINIFOR fermenteur de laboratoire-bioréacteur de paillasse et son utilisation dans les écoles et universités (pdf)
- FR - Le fermenteur et bioréacteur de laboratoire MINIFOR: Le joueur solitaire dans l’équipe des procédés en parallèle (pdf)
- FR - Comment comparer le coût d’un fermenteur ou bioréacteur avec sa valeur réelle ? (pdf)
- RU - Лабораторный ферменторбиореактор ЛАМБДА МИНИФОР (pdf)
- CZ - MINIFOR - laboratorní fermentor (pdf)
- ES - Manual de operaciones - LAMBDA MINIFOR Fermentador-Biorreactor de Laboratorio (pdf)
- ES - LAMBDA MINIFOR Biorreactor-fermentador de laboratorio - resumen de innovaciones y ventajas (pdf)
- ES - Fermentador-biorreactor de laboratorio LAMBDA MINIFOR para las escuelas y universidades (pdf)
- ES - MINIFOR - fermentador de laboratorio (pdf)
- ES - Fermentador y biorreactor LAMBDA MINIFOR: El solitario en procesos paralelos (pdf)
- ES - ¿Cómo comparar el coste y el valor real de un fermentador y biorreactor de laboratorio? (pdf)
2024
Simultane Verzuckerung und Fermentation (SSF): Der Bioreaktor LAMBDA MINIFOR wurde sowohl für die Fermentation von vorbehandelter fester Biomasse (10 %) in Gegenwart von Cellulase, β-Glucosidase und beimpft mit Lactobacillus rhamnosus (1.7 L, 37 °C, pH=5.5, 72 h) als auch für die anschliessende Fermentation von Hydrolysaten mit Bacillus megaterium (1.7 L, 35 °C, 48 h) verwendet.
Senila, L., Kovacs, E., Resz, M. A., Senila, M., Becze, A., & Roman, C. (2024). Life Cycle Assessment (LCA) of Bioplastics Production from Lignocellulosic Waste (Study Case: PLA and PHB). Polymers 2024, 16, 3330.
https://doi.org/10.3390/polym16233330
Anaerobe Batch-Kultivierung von C. butyricum im zuvor mit Argon gespülten Fermenter LAMBDA MINIFOR 3L: pH 5.6 (kontrolliert mit 1 M NaOH), 37 °C und 6000 rpm; Wasserverdrängungsmethode zur Messung der Gasproduktion, Überwachung des verdrängten Wasservolumens per Kamera und Flüssigkeits- und Gasprobenentnahme in regelmässigen Abständen.
Pištěková, H., Dusankova, M., Sopik, T., Klaban, J., Dostalkova, J., Moučka, R., & Sedlarik, V. Optimization of the Dark Fermentation Technique for Hydrogen Production Through Supplementation with Ascorbic Acid And/Or L-Cysteine by Clostridium Butyricum Ccdbc 11. Or L-Cysteine by Clostridium Butyricum Ccdbc, 11.
https://dx.doi.org/10.2139/ssrn.4973469
Alkoholische Fermentationen wurden unter Mikrovinifikationsbedingungen und in einem LAMBDA MINIFOR Bioreaktor mit kontrollierten Parametern (T = 20 °C, Rührfrequenz = 2 Hz) und Standardbedingungen (T = 12–14 °C) getestet.
Filimon, G. (2024). Monitorizarea fermentaţiei alcoolice a musturilor obţinute din soiuri de struguri rizogene. Universitatea Tehnică a Moldovei. Technical Scientific Conference of Undergraduate, Master and PhD Students: Chişinău, 27-29 martie 2024. Vol. 2.
URI: http://repository.utm.md/handle/5014/28059
Biologischer Abbau: Behandlung mariner Proben unter Zusatz von „Diesel-B5“ (10 %, 15 %, 20 %) als C-Quelle in belüfteten und gerührten LAMBDA MINIFOR Bioreaktoren (Pseudomonas sp.; pH 6.5; Inkubationstemperaturen 25 °C, 35 °C und 45 °C).
Peña Ventura, J. C. (2024). Determinación del ratio de biodegradación de hidrocarburos totales de petróleo empleando Pseudomonas sp. en agua de mar contaminada con diésel-B5. Universidad Nacional de Trujillo, Unidad de Postgrado en Ingeniería Química, Tesis de maestro en ingeniería química ambiental.
URI: https://hdl.handle.net/20.500.14414/22166
Die Mischkultur wurde in die Reaktionskammer des Bioreaktors LAMBDA MINIFOR inokuliert und bei 37 °C unter anaeroben Bedingungen kultiviert.
Khan, S. N., Ribeiro‐Vidal, H., Virto, L., Bravo, E., Nuevo, P., Koldsland, O. C., Hjortsjö, C. & Sanz, M. (2024). The Decontamination Effect of an Oscillating Chitosan Brush Compared With an Ultrasonic PEEK‐Tip: An In Vitro Study Using a Dynamic Biofilm Model. Clinical Oral Implants Research.
https://doi.org/10.1111/clr.14360
Die Batch-Fermentation von Dattelpalmensirup mit der Kokultur S. cerevisiae und P. stipitis ATCC 58785 wurde im LAMBDA MINIFOR 1L Advanced Kit Laborfermenter durchgeführt.
Shalsh, F. J., Gatte, E. H., Alsultan, I. I., Tariq, F. Z., Jassim, S. M., Saleh, M. T., & Alrazzaq, N. A. (2024). Bioplastic Compounds of Succinic Acid from Agriculture Waste; Date Palm Syrup And Date Palm Fronds. Nepal Journal of Biotechnology, 12(1), 32-39.
https://doi.org/10.54796/njb.v12i1.310
In vitro Entwicklung eines dynamischen Multispezies-Biofilmmodells auf Implantatoberflächen: Planktonisches Wachstum aus einem Gemisch aus 6 verschiedenen Bakterienstämmen im LAMBDA MINIFOR Bioreaktor (12 h), gefolgt von einer kontinuierlichen Kultur (30 ml/h) durch 2 Robbins-Geräte, die die sterilen Implantate enthalten (37 °C, anaerob, 72 h).
Khan, S. (2024). Efficacy of Mechanical Decontamination Strategies in the Treatment of Peri-implantitis. Doctoral thesis, University of Oslo.
URI: https://hdl.handle.net/10852/111365 (2024 August 07)
Dynamisches Multispezies-Biofilmmodell in vitro: Während des gesamten Inkubationsprozesses (Biofilme wachsen auf Implantatoberflächen) hält der Bioreaktor LAMBDA MINIFOR das Kulturmedium bei 37 °C, pH 7.2 und unter einer anaeroben Atmosphäre (10% H2, 10% CO2 und N2 als Füllgas).
Bravo, E., Arce, M., Ribeiro-Vidal, H., Herrera, D., & Sanz, M. (2024). The Impact of Candida albicans in the Development, Kinetics, Structure, and Cell Viability of Biofilms on Implant Surfaces—An In Vitro Study with a Validated Multispecies Biofilm Model. International Journal of Molecular Sciences, 25(6), 3277.
https://doi.org/10.3390/ijms25063277
Submerser Batch Fermentationen (Konsortien) sowie Fed-Batch-Fermentationen (L. coryniformis) im LAMBDA MINIFOR Bioreaktor und SIAM-Software: 72 h, Endarbeitsvolumen = 200 ml, T = 37 ± 0.5 °C, Mischung 0.5 Hz, CO2 Sparging 0.04 L/min, pH 6.5 ± 0.5 unter Verwendung von 1 M NaOH und 1 M H2SO4 zur automatischen pH-Einstellung; Probenahme in regelmässigen Abständen.
Buljubašić, E., Bambace, M. F., Christensen, M. H. L., Ng, K. S., Huertas‐Díaz, L., Sundekilde, U., Marietou, A. & Schwab, C. (2024). Novel Lactobacillaceae strains and consortia to produce propionate‐containing fermentates as biopreservatives. Microbial Biotechnology, 17(2), e14392.
https://doi.org/10.1111/1751-7915.14392
Das für das Wachstum von Biofilmen auf Implantatoberflächen validierte dynamische In-vitro-Multispezies-Biofilmmodell verwendet einen LAMBDA MINIFOR Bioreaktor, der die stabilen Bedingungen des proteinangereicherten BHI-Mediums hält: 37 °C, pH 7.2 und eine anaerobe Atmosphäre durch direktes Pumpen des Gasgemisches (10 % H2, 10 % CO2 und N2 Füllgas), wobei der Druck während des gesamten Inkubationsprozesses konstant bleibt.
Bravo, E., Arce, M., Ribeiro-Vidal, H., Herrera, D., & Sanz, M. (2024). The Impact of Candida albicans in the Development, Kinetics, Structure, and Cell Viability of Biofilms on Implant Surfaces. An In Vitro Study with a Validated Multispecies Biofilm Model.
https://doi.org/10.20944/preprints202402.1137.v1
Simuliertes menschliches Dickdarmmodell LAMBDA MINIFOR mit Basalnährmedium (37 °C, pH 6.8) und Kotaufschlämmungen
Pusuntisumpun, N., Tunsagool, P., Nitisinprasert, S., & Nakphaichit, M. (2024). Impacts of combining Limosilactobacillus reuteri KUB‐AC5 and Limosilactobacillus fermentum KUB‐D18 on overweight gut microbiota using a simulated human colon model. International Journal of Food Science & Technology.
https://doi.org/10.1111/ijfs.16941
Untersuchung von Nachernteverlusten von Früchten und Gemüse während der Lagerung unter kontrollierter Atmosphäre aufgrund der geringen O2-Belastung: 400 ml isolierte Tomatenzellen wurden in einem LAMBDA MINIFOR Bioreaktor (20 °C, pH 5.8) begast (10 L/h), um unterschiedliche O2-Konzentrationen (21 kPa, 5 kPa und 0 kPa) zu erreichen.
Mahomud, M. S., Islam, M., & Roy, J. (2024). Effect of low oxygen stress on the metabolic responses of tomato fruit cells. Heliyon, e24566.
https://doi.org/10.1016/j.heliyon.2024.e24566
Kontinuierliche Itaconsäure (IA) Fermentationen mit A. terreus spp.: LAMBDA MINIFOR 3L autoklavierbarer Bench-Top Laborfermenter (Arbeitsvolumen 1.8 Liter; Verdünnungsrate 0.007 h-1; 33 °C; kontrolliert niedriger pH-Wert; Belüftung eine Woche 1.5 vvm Luft, dann 0.2 vvm O2) mit Septum für sterile Probenahmen und LAMBDA FiSH-TAIL (3.0 s-1) für sanftes und effizientes Mischen zur optimalen Sauerstoffanreicherung und Gasaustausch ohne Luftflutung als vorteilhafte Eigenschaften für filamentöse Mikroorganismen, um Klumpenwachstum als effizienteste Morphologie für die IA-Produktion zu erreichen.
Hülber-Beyer, É. A., Nemestóthy, N., & Bélafi-Bakó, K. (2023). Case Study of Continuous Itaconic Acid Fermentation by Aspergillus Terreus in a Bench-Scale Bioreactor. Hungarian Journal of Industry and Chemistry, 51(2), 57-63.
https://doi.org/10.33927/hjic-2023-19
Photos der Morphologie im zeitlichen Verlauf der Fermentation: Fig. 1 auf https://hjic.mk.uni-pannon.hu/index.php/hjic/article/view/1214/1092 (2024 Feb. 08)
Senila, L., Cadar, O., Kovacs, E., Gal, E., Dan, M., Stupar, Z., Simedru, D., Senila, M. & Roman, C. (2023). L-Poly(lactic acid) Production by Microwave Irradiation of Lactic Acid Obtained from Lignocellulosic Wastes. Int. J. Mol. Sci. 2023, 24, 9817.
Senila, L., Gál, E., Kovacs, E., Cadar, O., Dan, M., Senila, M. & Roman, C. (2023). Poly(3-hydroxybutyrate) Production from Lignocellulosic Wastes Using Bacillus megaterium ATCC 14581. Polymers. 2023, 15, 4488.
Bravo, E., Serrano, B., Ribeiro-Vidal, H., Virto, L., Sánchez, I.S., Herrera, D. & Sanz, M. (2023). Biofilm formation on dental implants with a hybrid surface microtopography: An in vitro study in a validated multispecies dynamic biofilm model. John Wiley & Sons, Ltd., 0905-7161. Clinical Oral Implants Research, Volume 34, Issue 5, May 2023 Pages i-iii, 405-541.
Simulation eines In-vitro-Darmmodells mit LAMBDA MINIFOR 0.3L: Anaerobe Batch Fermentationen (37 °C, pH 6.8–6.9, 24 h) menschlicher Fäkalienaufschlämmung (1 % (v/v)) zur Bewertung der Wirkung von Triphala Extrakte (1 mg/ml) Co-Fermentation auf Mikrobiota und Stoffwechselveränderungen.
Kwandee, P., Somnuk, S., Wanikorn, B., Nakphaichit, M. & Tunsagool, P. (2023). Efficacy of Triphala extracts on the changes of obese fecal microbiome and metabolome in the human gut model. Journal of Traditional and Complementary Medicine, Volume 13, Issue 2, 2023, Pages 207-217, ISSN 2225-4110.
Das künstliche TWIN-SHIME in-vitro Darmmodell mit LAMBDA MINIFOR 0.3L Fermentern zur Untersuchung des mikrobiellen Ökosystems des Darms
Das Video https://www.youtube.com/watch?v=hXcpa0bXu6Q zeigt Assoc. Prof. Massalin Nakphaichit vor den TWIN-SHIME-Reaktoren in der Abteilung für Biotechnologie der Fakultät für Agrarindustrie an der Kasetsart-Universität (KU, Thailand)
LAMBDA MINIFOR 7L Bioreaktor: Entwicklung des hochdichten mikrobiellen Ökosystems RODMs für den effizienten Abbau von hochkonzentrierten Aromaten.
Ahmad, M., Yousaf, M., Han, J.-C., Huang, Y., Zhou, Y. & Tang, Z. (2023). Development of Biocatalytic Microbial Ecosystem (FPUS@RODMs@In-PAOREs) for Rapid and Sustainable Degradation of Various Refractory Organics. Journal of Hazardous Materials, 2023, 131514, ISSN 0304-3894,
https://doi.org/10.1016/j.jhazmat.2023.131514
Hybridomzellen (Inokulation 4.0 × 10E5 Zellen/ml (90 % Lebendanteil)) im Fed-Batch-Modus in einem LAMBDA MINIFOR Bioreaktor
Llamo, A., Hernández, D., García, C., González, M., Ferro, W., Garay, H., Diago, D., Fajardo, A., Espinosa, L., Padilla, S., Gómez, L., Chinea, G. & and Valdés, R. (2023). Gamma-Immunoglobulin Response Characterization, in COVID-19 Convalescent Patients, Against the Spike Protein S2 Subunit with Eight Linear Peptides for Monoclonal Antibody Generation. BioProcess J, 2023; 22.
https://doi.org/10.12665/J22OA.Llamo
Optimierung der Lipase-katalysierten Hydrolyse von Pflanzenölen: Steuerung und Überwachung durch einen LAMBDA MINIFOR Bioreaktor (pH-Wert, Temperatur, Reaktionszeit, Enzymbeladung und Öl/Wasser-Verhältnis der ReaktionsmischungFaillace, E., Brunini-Bronzini de Caraffa, V., Mariani, M., Berti, L., Maury, J. & Vincenti, S. (2023). Optimizing the First Step of the Biocatalytic Process for Green Leaf Volatiles Production: Lipase-Catalyzed Hydrolysis of Three Vegetable Oils. International Journal of Molecular Sciences. 2023; 24(15):12274.
Dumitru, M. & Ciurescu, G. (2023). Optimization of the fermentation conditions and survival of Bacillus licheniformis as freeze-dried powder for animal probiotic applications. Scientific Papers. Series D. Animal Science. Vol. LXVI, No. 2, 2023; ISSN 2285-5750; ISSN CD-ROM 2285-5769; ISSN Online 2393-2260; ISSN-L 2285-5750. https://www.animalsciencejournal.usamv.ro/pdf/2023/issue_2/Art10.pdf (2024 Jan. 02)
Alonso-Español, A., Bravo, E., Ribeiro-Vidal, H., Virto, L., Herrera, D., Alonso, B. & Sanz, M. (2023). The Antimicrobial Activity of Curcumin and Xanthohumol on Bacterial Biofilms Developed over Dental Implant Surfaces. Int. J. Mol. Sci. 2023, 24, 2335.
Pasteurisierung von Milch bei 70 °C für 30 min in LAMBDA MINIFOR Fermentern
/
LAMBDA MINIFOR Fermenter: Temperatureffekttests auf das Wachstum der Hefe Kazachstania unispora (initial ~10E6 CFU/ml) in Milch (800 ml, ~6 % Laktose): von 5 °C bis 40 °C (5, 10, 15, 20, 25, 27 , 30, 32, 35, 37 und 40 °C) bei pH 5.6 (automatische geregelt mit 2 M NaOH) und 240 U/min, bis die stationäre Phase erreicht wurde (Inline-Nahinfrarot-Trübungssensor Optek FC20-ASD10-N)
/
LAMBDA MINIFOR Fermenter für Kokulturexperimente von Lacticaseibacillus casei & Kazachstania unispora in modifiziertem MRS-Medium sowie in Stutenmilch (initial: ~10E6 CFU/ml, pH = 6.8) bei 25 °C
/
LAMBDA MINIFOR Fermenter für Kokulturexperimente bei 30 °C von Lactobacillus kefiri & Kazachstania unispora in modifiziertem MRS-Medium sowie in Stutenmilch (initial: ~10E6 CFU/ml, pH = 6.8)
Kondybayev, A., Achir, N., Mestres, C., Collombel, I., Strub, C., Grabulos, J., Akhmetsadykov, N., Aubakirova, A., Kamidinkyzy, U., Ghanmi, W. & Konuspayeva, G. (2023). Growth Kinetics of Kazachstania unispora and Its Interaction with Lactic Acid Bacteria during Qymyz Production. Fermentation 2023, 9, 101.
https://doi.org/10.3390/fermentation9020101
Pasotti, L., De Marchi, D., Casanova, M., Frusteri Chiacchiera, A., Cusella De Angelis, M. G., Calvio, C., & Magni, P. (2023). Design of a stable ethanologenic bacterial strain without heterologous plasmids and antibiotic resistance genes for efficient ethanol production from concentrated dairy waste. Biotechnology for Biofuels and Bioproducts, 16(1), 1-13.
https://doi.org/10.1186/s12896-017-0369-y
2022:
www.geniusjournals.org/index.php/emrp/article/view/2162 (2022 Sept. 22)
LAMBDA MINIFOR Bioreaktor & Laborfermenter für schulische Zwecke.
Wachstumsexperimente mit Milchsäurebakterien: Einfluss der Temperatur auf Lacticaseibacillus casei und Lactobacillus kefiri.
Kondybayev, A.; Konuspayeva, G.; Strub, C.; Loiseau, G.; Mestres, C.; Grabulos, J.; Manzano, M.; Akhmetsadykova, S. & Achir, N. (2022). Growth and Metabolism of Lacticaseibacillus casei and Lactobacillus kefiri Isolated from Qymyz, a Traditional Fermented Central Asian Beverage. Fermentation 2022, 8, 367.
Zwei kontinuierliche (HRT= 5 Tage) Rührtankfermenter LAMBDA MINIFOR wurden unter anaeroben Bedingungen (N2 Kopfbelüftung & Sparging) während 65 Tagen betrieben: jeweils 1 Liter Arbeitsvolumen (Änderung der Laktat-/Acetatkonzentrationen) inokuliert mit Caproat-produzierendem Klärschlamm (Caproiciproducens (Ruminococcaceae)); Temperaturregler (30 °C, eingebautes IR-Heizelement, Sonde Mettler InPro 3253) und pH-Regler (pH 5.5, NaOH 2 M, HCl 0,5 M)) mit vier peristaltischen Pumpen (Mediumzufuhr, Abernte, Base & Säure) und täglichen Flüssigkeitsproben zur Analyse von Carboxylaten und Alkoholen.
Koninuierliche Kultur: 1 Monat Chemostat im LAMBDA MINIFOR PBR Photobioreaktor(1L; 30 °C; 1 L/min mit 0.5 % CO2 angereichterter Luft; 5 Hz, pH 8; weisses Licht) mit Cyanobakterien Synechocystis sp. PCC 6803
Behle, A., Dietsch, M., Goldschmidt, L., Murugathas, W., Berwanger, L.C., Burmester, J., Yao, L., Brandt, D., Busche, T., Kalinowski, J., Hudson, E.P., Ebenhöh, O., Axmann, I.M. & Machné, R. (2022). Manipulation of topoisomerase expression inhibits cell division but not growth and reveals a distinctive promoter structure in Synechocystis. Nucleic Acids Research, Volume 50, Issue 22, 9 December 2022, Pages 12790–12808
https://doi.org/10.1093/nar/gkac1132
Biokatalytische Trennung von Lupaniracemat in Industrieabwässern durch Pseudomonas putida LPK411 unter Verwendung eines Labor‐Bioreaktors LAMBDA MINIFOR 0.4L im Batch‐Betrieb.
Parmaki, S., Esteves, T., Gonçalves, J.M.J. Catenacci, A., Malpei, F., Ferreira, F.C., Afonso C.A.M & Koutinas, M. (2022). Selective microbial resolution of lupanine racemate: Bioprocess development and the impact of carbon catabolite repression on industrial wastewater valorisation. Biomass Conv. Bioref. (2022).
https://doi.org/10.1007/s13399-022-03383-3
Zur Freisetzung bioaktiver Peptide wurde verdünntes Kiwicha-Proteinisolat (KPI) aus Amaranthus caudatus L. Samenmehl einer enzymatischen Hydrolyse mit Bioprotease LA-660 unter Verwendung eines LAMBDA MINIFOR Bioreaktors für die kontinuierliche Mischung, pH- und Temperaturkontrolle (pH 8; 50 °C) unterzogen
Martinez-Lopez, A., Rivero-Pino, F., Villanueva, A., Toscano, R., Grao-Cruces, E., Marquez-Paradas, E., Martin, M.E., Montserrat-de la Paz, S. & Millan-Linaresa, M.C. (2022). Kiwicha (Amaranthus caudatus L.) protein hydrolysates reduce intestinal inflammation by modulating the NLRP3 inflammasome pathway. Food & Function 2022 Oct 21.
https://doi.org/10.1039/D2FO02177C
Escherichia coli (E. coli; E44Δ) Mutantenstamm zur Produktion grosser Mengen von Aussenmembranvesikeln (OMV) in einem LAMBDA MINIFOR 7L Fermenter
Allahghadry, T., Bojesen, A.M., Whitehead, B.J. and Antenucci, F. (2022). Clarification of large-volume bacterial cultures using a centrifuge-free protocol. J Appl Microbiol. Accepted Author Manuscript.
https://doi.org/10.1111/jam.15608
2021:
Flüssigphasen-Experimente (Hemicellulose-Hydrolysat) zur Produktion von Xylit: Fermentation von 250 ml entgiftetem Hydrolysat im Bench-top Fermenter LAMBDA MINIFOR 1L (aerob, 60h, pH= 5.0, T = 30°).
Shalsh, D., Nagimm, D., Alrheem, M.A. & Alrheem, S.A. (2021). Batch fermentation and Simultaneous Saccharification and Fermentation (SSF) processes by Meyerozyma Guilliermondii Strain F22 and Saccharomyces cerecvisae for xylitol and bioethanol co-production. Al-Qadisiyah Journal of Pure Science, 26(4), 80–94.
https://doi.org/10.29350/qjps.2021.26.4.1347
Für die wichtigsten intrinsischen Faktoren wurden im LAMBDA MINIFOR 1L Fermenter mit Abluftkondensator das Wachstum, der Glukoseverbrauch und die Ethanolproduktion von Saccharomyces cerevisiae LM modelliert.
Kouamé, C., Loiseau, G., Grabulos, J., Boulanger, R. & Mestres, C. (2021). Development of a model for the alcoholic fermentation of cocoa beans by a Saccharomyces cerevisiae strain. International Journal of Food Microbiology, Volume 337, 2021, 108917, ISSN 0168-1605.
https://doi.org/10.1016/j.ijfoodmicro.2020.108917
Kontinuierliche Kultur des Cyanobakteriums Synechocystis sp. PCC 6803 im modularen Labor-Photobioreaktor
Behle, A., Dietsch, M., Goldschmidt, L., Murugathas, W., Brandt, D., Busche, T., Kalinowski, J., Ebenhöh, O., Axmann, I. M. & Machné, R. (2021) Uncoupling of the Diurnal Growth Program by Artificial Genome Relaxation in Synechocystis sp. PCC 6803. bioRxiv 2021.07.26.453758.
https://doi.org/10.1101/2021.07.26.453758
Hydrolysen von Kiwicha-Protein-Isolat (KPI 10% w/v) werden unter kontinuierlichem Rühren im LAMBDA MINIFOR Fermenter-Bioreaktor bei kontrollierten pH- und Temperaturbedingungen durchgeführt: Die Bioprotease LA-660 wird in einem Verhältnis Enzym/Substrat = 0,3 AU/g Protein (pH 8) für 5, 10, 15, 30 und 60 Minuten zugegeben.
Paz, S. M. D. L., Martinez-Lopez, A., Villanueva-Lazo, A., Pedroche, J., Millan, F., & Millan-Linares, M. C. (2021). Identification and characterization of novel antioxidant protein hydrolysates from kiwicha (Amaranthus caudatus L.). Antioxidants, 10(5), 645.
https://doi.org/10.3390/antiox10050645
Die Biotransformation von weisser Sorghum-Biomasse wurde unter ähnlichen Betriebsbedingungen wie beim MixAlco-Prozess im LAMBDA MINIFOR Bioreaktor durchgeführt.
Shalsh, F.J., Alrazzaq, N.A., Nagimm D.K., Alrheem, M.A., Alrheem S.A. & Abd-alalah, K. (2021). Bioconversion of white sorghum biomass using MixAlco fermentation process. DYSONA – Applied Science. 2021(2), 21-27. ISSN 2708-6283.
https://doi.org/10.30493/DAS.2021.248966
2020:
Verschiedene Hefestämme zur Untersuchung des Stoffwechselzyklus und Stoffwechselwegs wurden im LAMBDA MINIFOR 0.4L Fermenter kultiviert:
A) 200 ml Batch mit YMC-YE/YMC-MD-Medium, pH 3.5, Belüftung 0.15 l/min, Temperatur 30 °C; B) 6 h aushungern; C) kontinuierliche Kultur: Verdünnungsrate 0.082 1/h.
J. Feltham, S. Xi, S. Murray, M. Wouters, J. Urdiain-Arraiza, C. George, A. Townley, E. Roberts, R. Fisher, S. Liberatori, S. Mohammed, B. Kessler & J. Mellor. (2020). Transcriptional changes are regulated by metabolic pathway dynamics but decoupled from protein levels. bioRxiv 833921.
https://doi.org/10.1101/833921
Um flüchtige Fettsäuren (VFA) aus Ernterückständen (Lignozellulose-Biomasse) zu produzieren, wird ein LAMBDA MINIFOR Bioreaktor (ausgestattet mit zwei peristaltischen Pumpen (Speichel- und Permeatpumpe), einem Überkopfmischer, einer Redox-Temperatur-pH-Sonde, einer Temperiereinheit und einem submersen Hohlfasermembranmodul) als Pansenmembranbioreaktor zur Nachahmung des Verdauungssystems von Wiederkäuern verwendet.
Nguyen, A.Q., Nguyen, L.N., Abu Hasan Johir, M., Ngo, H-H., Chaves, A.V. & Nghiem, L.D. (2020) Derivation of volatile fatty acid from crop residues digestion using a rumen membrane bioreactor: a feasibility study. Bioresource Technology 2020.
https://doi.org/10.1016/j.biortech.2020.123571
Enzymatischen Hydrolyse im Labormassstab im LAMBDA MINIFOR Bioreaktor: Die vorbehandelten Weinlaubabfälle wurden mit Natriumchlorit delignifiziert und anschliessend mit Cellulase (aus Trichoderma reesei Pilz und b-Glucosidase) enzymatisch hydrolysiert.
Eniko Kovacs, Daniela Alexandra Scurtu, Lacrimioara Senila, Oana Cadar, Diana Elena Dumitras & Cecilia Roman (2020). Green Protocols for the Isolation of Carbohydrates from Vineyard Vine-Shoot Waste. Analytical Letters.
https://doi.org/10.1080/00032719.2020.1721001
Biotechnologischen Herstellung von Itaconsäure aus Glukose im LAMBDA MINIFOR Bioreaktor mit Hilfe des Pilzstamms Aspergillus terreus: 1.8 L Medium mit 120 g/L Glukose als Substrat, Batch-Modus, aerob: Belüftung 2 L/min (STP) = 6,5 mg/L Anfangs-pO2, 37 °C, 2 Hz Rührung, pH 3)
Nemestóthy, N., Komáromy, P., Bakonyi, P. et al. (2020). Carbohydrate to Itaconic Acid Conversion by Aspergillus terreus and the Evaluation of Process Monitoring Based on the Measurement of CO2 Waste and Biomass. Valorization 2020.
https://doi.org/10.1007/s12649-019-00729-3
2019:
Turbidostat LAMBDA MINIFOR 0.4L Bioreaktor mit LAMBDA PRECIFLOW Mediumpumpen für Experimente mit rekombinanten Zellen.
Pasotti, L., Bellato, M., Politi, N., Casanova, M., ucca, S., Gabriella, M., De Angelis, C. & Magni, P. (2019). A synthetic close-loop controller circuit for the regulation of an extracellular molecule by engineered bacteria. IEEE Trans Biomed Circuits Syst. 2019 Feb; 13(1):248-258.
https://doi.org/10.1109/TBCAS.2018.2883350
pH-Optimierung für die durch Aspergillus terreus katalysierte aerobe Produktion von Itaconsäure in einem LAMBDA MINIFOR Bioreaktor: Batch Arbeitsvolumen 1.8 L, Medium mit 120 g/L Glucosesubstrat, 37 °C, pH 3 – pH 2.5 – pH 4 – pH 3 – pH 2.5, Mischung 2 Hz, Belüftung 1,5 L (STP)/min.
Komáromy, K., Bakonyi, P., Kucska, A., Tóth, G., Gubicza, L., Bélafi-Bakó, K. & Nemestóthy, N. (2019). Optimized pH and Its Control Strategy Lead to Enhanced Itaconic Acid Fermentation by Aspergillus terreus on Glucose Substrate. Fermentation 2019, 5(2), 31
https://doi.org/10.3390/fermentation5020031
Herstellung von Rhamnolipid (RL) mit Pseudomonas aeruginosa im Laborfermenter LAMBDA MINIFOR 7L (30 °C, pH 6.5, Batch, 120 h) für die Aufarbeitung des Sekundärmethaboliten.
Faqri, A. F., Hayder, N.H. & Hashim, A.J. (2019). Lab-scale production of Rhamnolipid by Pseudomonas Aeruginosa A3 and study its synergistic effect with certain antibiotics against some pathogenic bacteria. Iraqi Journal of Agricultural Sciences –2019:50(5):1290-1301.
https://doi.org/10.13140/RG.2.2.10802.35520
(Siehe auch https://bioreactor.ch/pseudomonas-aeruginosa-biotensid-rhamnolipid-laborfermenter/ )
2018:
In einem LAMBDA MINIFOR Bioreaktor wurde die Methode zur Produktion von Pro-siRNA mit hoher Ausbeute für den Grossmassstab entwickelt.
Kaur, G., Cheung, H. C., Xu, W., Wong, J. V., Chan, F. F., Li, Y., McReynolds, L. & Huang, L. (2018). Milligram scale production of potent recombinant small interfering RNAs in Escherichia coli. Biotechnology and Bioengineering, 115(9), 2280-2291.
https://doi.org/10.1002/bit.26740
Der LAMBDA MINIFOR Tisch-Laborfermenter wurde für die Bioethanolproduktion unter optimierten Bedingungen verwendet: 3.5 Liter Medium mit aktiviertem S. cerevisiae (Inokulation 2 % (v/v), OD= 0.5, 1.5×10e8 KBE/ml) in aerober Fermentation für 24 h bei 30 °C, dann anaerobe Bedingungen für 70 h bei 30 °C.
Hayder, N. H., Flayeh, H. M., & Ahmed, A. W. (2018). Optimization of bioethanol production from biodegradable municipal solid waste using response surface methodology (RSM). Journal of Engineering and Sustainable Development, 22(1), 47-64.
https://www.iasj.net/iasj/download/28dcbea4ab5f5ba8 (2024 Feb. 05)
2017:
Vergleich der experimentellen und theoretischen Produktion von Biogas: 2 Liter Inokulum wurden anaerob bei 35 °C im LAMBDA MINIFOR Bioreaktor inkubiert.
El Asri, O., & Afilal, M. E. (2018). Comparison of the experimental and theoretical production of biogas by monosaccharides, disaccharides, and amino acids. International Journal of Environmental Science and Technology, 15(9), 1957-1966.
https://doi.org/10.1007/s13762-017-1570-1
Untersuchung des Metabolismus von isolierten Feldsalatzellen (Valerianella locusta (L). Laterr.) bei Zuckermangel unter O2-Stressbedingungen unter Verwendung von 13C [U-13C6] markierter Glucose in einem LAMBDA MINIFOR Tisch-Laborbioreaktor (dunkel, 250 ml, pH 5.8, 18 °C, Belüftung 10 L/h)
Victor, B. M. M., Ampofo-Asiama, J., Hertog, M., Geeraerd, A. H., & Nicolai, B. M. (2017). Metabolic profiling reveals a coordinated response of isolated lamb's (Valerianella locusta, L.) lettuce cells to sugar starvation and low oxygen stress. Postharvest Biology and Technology, 126, 23-33.
https://doi.org/10.1016/j.postharvbio.2016.12.004
LAMBDA MINIFOR Fermenter werden Fermenter mit Mischsystem und mit kontinuierlicher anaeroben Strömung (CSTR) für die anaerobe Vergärung organischer Feststoffabfälle eingesetzt
Nakasima-López, M., Taboada-González, P., Aguilar-Virgen, Q., & Velázquez-Limón, N. (2017). Adaptación de inóculos durante el arranque de la digestión anaerobia con residuos sólidos orgánicos. Información tecnológica, 28(1), 199-208.
https://dx.doi.org/10.4067/S0718-07642017000100020
Die Auswirkung unterschiedlicher Temperaturen auf den Zuckermangel in aus frischem Blattgemüse isolierten Zellen wurde im Bioreaktor LAMBDA MINIFOR untersucht
Mbong, V. B. M., Ampofo-Asiama, J., Hertog, M. L., Geeraerd, A. H., & Nicolai, B. M. (2017). The effect of temperature on the metabolic response of lamb’s lettuce (Valerianella locusta,(L), Laterr.) cells to sugar starvation. Postharvest Biology and Technology, 125, 1-12.
https://doi.org/10.1016/j.postharvbio.2016.10.013
Produktion von CB.Hep-1-mAb Antikörpern im LAMBDA MINIFOR Bioreaktor mit Maus-Hybridom-Zellkultur im proteinfreien Medien
Valdés, R., Aragón, H., González, M., Hernández, D., Geada, D., Goitizolo, D., Ferro, W., Pérez, A., García, J., Masforrol, Y, Aguilar, P., Márquez, G., LaO, M., González, T., Calvo, Y., Hernández, A., Menéndez, G. & Tamayo, A. (2017). Mouse Hybridoma Cell Culture in a Protein-Free Medium Using a Bio-Mimicking Fish-Tail Disc Stirred Bioreactor. BioProcessing Journal, 16(1).
https://doi.org/10.12665/J161.Valdes
2016:
Robuste Zellulose-Ethanol-Produktion aus Zuckerrohr-Bagasse mit Saccharomyces cerevisiae ATCC 20602 im Laborbioreaktor LAMBDA MINIFOR unter aeroben und anaeroben Bedingungen mit kontrollierter Redoxpotentialmessung.
Jabasingh, S. A., Lalith, D., Prabhu, M. A., Yimam, A., & Zewdu, T. (2016). Catalytic conversion of sugarcane bagasse to cellulosic ethanol: TiO2 coupled nanocellulose as an effective hydrolysis enhancer. Carbohydrate polymers, 136, 700-709.
https://doi.org/10.1016/j.carbpol.2015.09.098
2015:
Das Bioreaktorsystem LAMBDA MINIFOR als künstliches Mundsystem für das Wachstum von Biofilmen
LA BOCA ARTIFICIAL DE DENTAID UNA REVOLUCIÓN EN INVESTIGACIÓN BUCODENTAL
DENTAID EXPERTISE, PUBLICACIÓN PARA PROFESIONALES DE LA ODONTOLOGÍA, NÚM. 18.
https://aprenderly.com/doc/3463742/la-boca-artificial-de-dentaid-una-revolución-en-investiga…?page=5 (2024 Feb. 05)
Das Cas9-Protein von S. pyogenes wurde mit E. coli unter Verwendung eines computergesteuerten LAMBDA MINIFOR 3L-Bioreaktors im Batch-Modus und anschliessender exponentieller Fütterung exprimiert.
Ménoret, S., De Cian, A., Tesson, L., Remy, S., Usal, C., Boulé, J. B., Boix, C., Fontanière, S., Crénéguy, A., Nguyen, T.H., Brusselle, L., Thinard, R., Gauguier, D., Concordet, J.-P., Cherifi, Y., Fraichard, A., Giovannangeli, C. & Anegon, I. (2015). Homology-directed repair in rodent zygotes using Cas9 and TALEN engineered proteins. Scientific reports, 5(1), 14410.
https://doi.org/10.1038/srep14410
Fermentation im Labormassstab von gentechnisch veränderten Mikroorganismen im Bioreaktor LAMBDA MINIFOR zur effizienten Umwandlung von Laktose in Ethanol
Pasotti, L., Zucca, S., Casanova, M., Massaiu, I., Mazzini, G., Micoli, G., Calvio, C., Cusella de Angelis, M.G. & Magni, P. (2015, August). Methods for genetic optimization of biocatalysts for biofuel production from dairy waste through synthetic biology. In 2015 37th Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC) (pp. 953-956). IEEE.
https://doi.org/10.1109/EMBC.2015.7318521
Biofilm-Modell: Im LAMBDA MINIFOR Bioreaktor wurden sechs Spezies Bakterien kultiviert, um deren Biofilmentwicklung unter Strömungs- und Scherbedingungen zu bewerten
Salli, K. M., & Ouwehand, A. C. (2015). The use of in vitro model systems to study dental biofilms associated with caries: a short review. Journal of oral microbiology, 7(1), 26149.
https://doi.org/10.3402/jom.v7.26149
Quantifizierung ribosomaler Proteine (RPs) aus Hefezellen, die im LAMBDA MINIFOR-Bioreaktor kultiviert wurden, und embryonalen Stammzellen der Maus (ESC) zur Untersuchung der Stöchiometrie der Kern-RPs
Slavov, N., Semrau, S., Airoldi, E., Budnik, B., & van Oudenaarden, A. (2015). Differential stoichiometry among core ribosomal proteins. Cell reports, 13(5), 865-873.
https://doi.org/10.1016/j.celrep.2015.09.056
Harvard University, USA; Broad Institute of MIT and Harvard, USA and Hubrecht Institute, Netherlands.
2014:
Kultivierung von Mikroalgen (Chlorella vulgaris Beyerinck) im Laborbioreaktor LAMBDA MINIFOR
Heitur, H. (2014). Mikrovetika Chlorella vulgaris Beyerincki kasvatamine CO2 sidumise eesmärgil (Master's thesis).
https://hdl.handle.net/10492/1842 (2024 Feb. 05)
Eesti Maaülikool (Estonian University of Life Sciences), Estonia.
Untersuchung der aeroben Glykolyse und des Energieflusses: Wachstum von Hefekulturen (DBY12007) im Fliessgleichgewicht mit Hilfe des Laborfermenters LAMBDA MINIFOR
Slavov, N., Budnik, B. A., Schwab, D., Airoldi, E. M., & van Oudenaarden, A. (2014). Constant growth rate can be supported by decreasing energy flux and increasing aerobic glycolysis. Cell reports, 7(3), 705-714.
https://doi.org/10.1016/j.celrep.2014.03.057
Massachusetts Institute of Technology, USA; Harvard University, USA; Hubrecht Institute, Royal Netherlands Academy of Arts and Sciences and University Medical Center Utrecht, Netherlands and Princeton University, USA.
Selektive und nicht-selektive Batch-Fermentation von Dattelextrakt unter Verwendung von Saccharomyces cerevisiae (glukoseselektive Stämme ATCC 36858 und ATCC 36859), untersucht im LAMBDA MINIFOR-Fermenter
Putra, M. D., Abasaeed, A. E., Zeinelabdeen, M. A., Gaily, M. H., & Sulieman, A. K. (2014, April). Selective fermentation of pitted dates by S. cerevisiae for the production of concentrated fructose syrups and ethanol. In Journal of Physics: Conference Series (Vol. 495, No. 1, p. 012034). IOP Publishing.
https://doi.org/10.1088/1742-6596/495/1/012034
King Saud University, Chemical Engineering Department, Saudi Arabia
Untersuchung der metabolischen Stressreaktion von Tomatenzellkulturen (Lycopersicum esculentum) auf niedrigen Sauerstoffgehalt
Ampofo‐Asiama, J., Baiye, V. M. M., Hertog, M. L. A. T. M., Waelkens, E., Geeraerd, A. H., & Nicolai, B. M. (2014). The metabolic response of cultured tomato cells to low oxygen stress. Plant Biology, 16(3), 594-606.
https://doi.org/10.1111/plb.12094
KU Leuven, Belgium; Flanders Centre of Postharvest Technology (VCBT), Leuven, Belgium.
Die Optimierung des Mediums und die Wachstumskinetik von S. marcescens wurden in einem Benchtop-Bioreaktor LAMBDA MINIFOR 7L Advanced Kit untersucht: Batch-Kultivierungen bei 30 °C, 3 L/min Belüftung, 4 Hz Mischung, pH 6, Polypropylenglykol als Antischaummittel.
Mohammed, S. J. (2014). Optimization Of medium Composition for increasing prodigiosin production by local isolate of Serratia marcescens. Doctoral thesis, Al-Khwarizmi College of engineering, Department of Biochemical engineering, University of Baghdad.
https://doi.org/10.13140/RG.2.2.18638.7968
LAMBDA MINIFOR Bioreaktor zur Züchtung oraler Bakterien (Streptococcus oralis, Actinomyces naeslundii, Veillonella parvula, Fusobacterium nucleatum, Aggregatibacter actinomycetemcomitans und Porphyromonas gingivalis) unter planktonischen Bedingungen
Blanc, V., Isabal, S., Sanchez, M. C., Llama‐Palacios, A., Herrera, D., Sanz, M., & León, R. (2014). Characterization and application of a flow system for in vitro multispecies oral biofilm formation. Journal of Periodontal Research, 49(3), 323-332.
https://doi.org/10.1111/jre.12110
DENTAID S. L., Cerdanyola del Vallès, Spain; ETEP Research Group, University Complutense of Madrid, Spain.
LAMBDA MINIFOR Bioreaktor zur Expression rekombinanter Proteine (Chemokine) in E. coli
Kramp, B. (2014). Establishing the interaction between the CC chemokine ligand 5 and the receptors CCR1 and CCR (Doctoral dissertation, Aachen, Techn. Hochsch., Diss., 2013).
https://core.ac.uk/download/pdf/36589112.pdf (2024 Feb. 05)
RWTH Aachen, Germany.
2013:
Entwicklung eines Biofilmmodells (S. oralis, A. naeslundii, V. parvula, F. nucleatum, A. actinomycetemcomitans und P. gingivalis) im kontinuierlichen Durchfluss in einem LAMBDA MINIFOR 0.4L Bioreaktor.
Suárez Soto, I. (2013). Desarrollo del modelo de boca artificial en flujo continuo en el biorreactor Lambda Minifor. Ene, 10, 41.
https://docta.ucm.es/rest/api/core/bitstreams/39d8318b-a49b-4cb3-a164-e4faab18f52b/content (2024 Feb. 05)
Rekombinante Expression von Met-CCL5, Protease-resistentem CXCL12 (S4V) und F1-CX3CL1 in E. coli unter Verwendung eines LAMBDA MINIFOR-Fermenters/Bioreaktors zur Untersuchung ihrer Rolle bei Herz-Kreislauf-Erkrankungen
Projahn, D. (2013). Generation, function and therapeutic application of chemotactic cytokines in cardiovascular diseases (Doctoral dissertation, Aachen, Techn. Hochsch., Diss., 2013).
https://publications.rwth-aachen.de/record/229207/files/4840.pdf (2024 Feb. 05)
RWTH Aachen, Germany.
Expression des Proteins Caf1 in Escherichia coli im LAMBDA MINIFOR Fermenter zur Untersuchung der Adhäsion, Form und Anzahl fokaler Adhäsionen von Säugetierzellen
Machado Roque, A. I. (2013). Protein scaffolds for cell culture (Doctoral dissertation, Newcastle University).
URI: https://hdl.handle.net/10443/1843 (2024 Feb. 05)
Newcastle University, UK.
Kontrolliertes Wachstum von Staphylococcus aureus unter verschiedenen Konzentrationen von BAC (Benzalkoniumchlorid) im LAMBDA MINIFOR-Fermenter
Cervinkova, D., Babak, V., Marosevic, D., Kubikova, I., & Jaglic, Z. (2013). The role of the qacA gene in mediating resistance to quaternary ammonium compounds. Microbial Drug Resistance, 19(3), 160-167.
https://doi.org/10.1089/mdr.2012.0154
Veterinary Research Institute, Brno, Czech Republic.
2012:
Effektive Produktion von Biobutanol aus landwirtschaftlichen Abfällen (Riesen-Bärenklau, Heu) mit dem LAMBDA MINIFOR Labor-Tischfermenter
Mezule, L., Tihomirova, K., Nescerecka, A., & Juhna, T. (2012). Biobutanol production from agricultural waste: A simple approach for pre-treatment and hydrolysis. Latvian Journal of Chemistry, 51(4), 407.
https://doi.org/10.2478/v10161-012-0028-5
2011:
Bioethanolproduktion mit Hefe (S. cerevisiae) im LAMBDA MINIFOR-Fermenter
Burešová, I., & Hřivna, L. (2011). Effect of wheat gluten proteins on bioethanol yield from grain. Applied Energy, 88(4), 1205-1210.
https://doi.org/10.1016/j.apenergy.2010.10.036
2010:
Anaerobe Fermentation der Glukosekomponente im Dattelextrakt durch die Hefe Saccharomyces cerevisiae
Gaily, M. H., Elhassan, B. M., Abasaeed, A. E., & Al-Zahrani, S. M. (2010). A direct process for the production of high fructose syrups from dates extracts. International Journal of Food Engineering, 6(3).
https://doi.org/10.2202/1556-3758.1879
King Saud University, Saudi Arabia; University of Khartoum, Sudan
Untersuchung des Potenzials von Baumtabakstängeln (Nicotiana glauca r. Grah.) als Bioethanol-Rohstoff mit dem LAMBDA MINIFOR-Fermenter
Sánchez, F., Curt, M. D., Barreiro, M., Fernández, J., Agüera, J. M., Uceda, M., & Zaragoza, G. (2010). TREE TOBACCO (NICOTIANA GLAUCA R. GRAH.) STEMS AS A BIOETHANOL FEEDSTOCK. 18th European Biomass Conference and Exhibition, 3-7 May 2010, Lyon, France.
Dpt. Producción Vegetal: Botánica y Protección Vegetal. Universidad Politécnica de Madrid (UPM), Madrid, Spain
2009:
Bestimmung des alkoholischen Potenzials von nicht-zellulosehaltigen Kohlenhydraten aus Feigenkaktuskladen durch Fermentation mit der Hefe Saccharomyces cerevisiae (kommerzielle Stämme)
Sánchez, F., Curt, M. D., Fernández, J., Agüera, J. M., Uceda, M., & Zaragoza, G. (2009). Bioethanol production from prickly pear (Opuntia ficus-indica (L.) Mill.) cladodes. In Proc. 17th European Biomass Conference. Pub. ETA-Florence Renewable Energies & WIP-Renewable Energies. ISBN (pp. 978-88).
Dpt. Producción Vegetal: Botánica y Protección Vegetal. Universidad Politécnica de Madrid (UPM), Madrid, Spain
2007:
LAMBDA MINIFOR für die anaerobe Expression
Park, M. O., Mizutani, T., & Jones, P. R. (2007). Glyceraldehyde-3-phosphate ferredoxin oxidoreductase from Methanococcus maripaludis. Journal of bacteriology, 189(20), 7281-7289.
https://doi.org/10.1128/jb.00828-07
Research and Development Division, Fujirebio Incorporated, Japan.
2006:
Bench-top Bioreaktoren LAMBDA MINIFOR (1 - 5 Liter) für das Hybridoma Wachstum mit hoher Zelldichte und hoher Ausbeute der mAb Produktion
Howard, G.C., & Kaser, M.R. (Eds.). (2006). Making and Using Antibodies: A Practical Handbook (1st ed.). CRC Press.
https://doi.org/10.1201/9781420005196
2005:
pH-Wert und Temperatur werden kontinuierlich mit dem LAMBDA MINIFOR Bioreaktor und der SIAM PC-Software aufgezeichnet
Chaignon, P., Cortial, S., Guerineau, V., Adeline, M. T., Giannotti, C.,
Do you sell/ship to the USA?
Yes, we do supply our instruments directly with door-to-door delivery option by the parcel services to the USA.
What is the availability of the product?
We have the instruments in stock. We would just have to configure the instruments according to your requirements and perform quality control before shipping.
Is there a warranty?
We offer a 2 year warranty for MINIFOR fermentor / bioreactor and 5 year warranty for the PRECIFLOW & MULTIFLOW peristaltic pumps.
Does this fermentor work on both mammalian cells and yeast cells?
Yes, MINIFOR fermentor and bioreactor can be used for mammalian and yeast cell cultures (More information at www.fermentor.net/applications).
Is there flexibility in the top plate to add or remove probes?
Yes, MINIFOR has free ports in the headspace for the additional probes (sensors). Multiple ports and other effective solutions in the fermentation glass vess make the MINIFOR configuration equivalent to 16 to 22 classical ports (it is possible to increase the number of ports – custom made solution)
Is the equipment suitable for use in pure / mixed culture?
Yes, MINIFOR is suitable for pure as well as mixed culture. The stirrer is strong and can easily be adapted according to the types of cultures and working volumes.
Why is MINIFOR perfectly suitable for parallel processes?
Each unit stays independent as it is equipped with a control panel and display and at a single glance shows the parameter values. All parameters are regulated locally inside each fermenter-bioreactor unit.
This allows fast and precise parameter regulation and never having to worry about leaving a vessel unattended. Further advantage is that in case there are problems with one unit, the other units will still keep running.
How important is the slowdown in parameter regulation while running 12 bioreactors in parallel?
An important aspect to consider – which, however, does not play a role in the LAMBDA MINIFOR parallel system because each MINIFOR fermenter comes with its proper regulation unit that measures and controls all parameters locally. As a consequence the quality of the measurement and regulation is not affected by long transmission times and dead times in regulation.
How much space is required for the MINIFOR unit?
Footprint: approximately a sheet of paper
Dimensions: 22 cm x 38 cm x 40 cm (W x H x D)
 Kontinuierliche Fermentation (Chemostat)
Das LAMBDA Waagemodul für MINIFOR Laborfermenter ermöglicht vollautomatische Chemostat Fermentationen.
Mehr
Kontinuierliche Fermentation (Chemostat)
Das LAMBDA Waagemodul für MINIFOR Laborfermenter ermöglicht vollautomatische Chemostat Fermentationen.
Mehr
 REDOX-Potentialmessung [mV]
LAMBDA REDOX – Redoxpotentialmessung (-999 mV bis +999 mV)
Mehr
REDOX-Potentialmessung [mV]
LAMBDA REDOX – Redoxpotentialmessung (-999 mV bis +999 mV)
Mehr
 Automatisches Gasgemisch für das Labor
MINI-4-GAS – Das automatische Gasgemisch für Laborfermenter und Bioreaktoren
Mehr
Automatisches Gasgemisch für das Labor
MINI-4-GAS – Das automatische Gasgemisch für Laborfermenter und Bioreaktoren
Mehr
 Antischaum-System für Bioreaktoren & Laborfermenter
ANTIFO & DOZITO – Das kleinste automatisierte Antischaum-System der Welt
Mehr
Antischaum-System für Bioreaktoren & Laborfermenter
ANTIFO & DOZITO – Das kleinste automatisierte Antischaum-System der Welt
Mehr
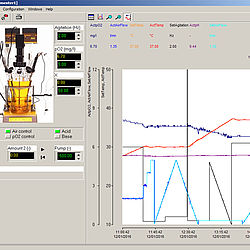 PC Software für Fermentationen
FNet - Fermentationssoftware für Bioreaktoren
Mehr
PC Software für Fermentationen
FNet - Fermentationssoftware für Bioreaktoren
Mehr
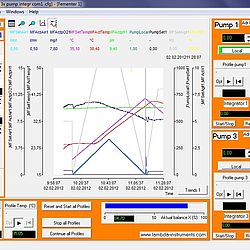 Automationssoftware für Labor & Pilotanlage
SIAM – Industrielle Automationssoftware für Fermentation und Zellkulturen
Mehr
Automationssoftware für Labor & Pilotanlage
SIAM – Industrielle Automationssoftware für Fermentation und Zellkulturen
Mehr
 PC-Software für die Gasmischung
Mehr
PC-Software für die Gasmischung
Mehr
 OXYMETER - O2 Messgerät (%)
LAMBDA OXYMETER für Benchtop Bioreaktoren misst die Sauerstoffkonzentration (0 – 25 % O2)
Mehr
OXYMETER - O2 Messgerät (%)
LAMBDA OXYMETER für Benchtop Bioreaktoren misst die Sauerstoffkonzentration (0 – 25 % O2)
Mehr
 CARBOMETER - CO2 Messgerät (%)
LAMBDA CARBOMETER für Laborreaktoren misst die Kohlenstoffdioxid-Konzentration (0 – 100 % CO2)
Mehr
CARBOMETER - CO2 Messgerät (%)
LAMBDA CARBOMETER für Laborreaktoren misst die Kohlenstoffdioxid-Konzentration (0 – 100 % CO2)
Mehr
 METHAMETER – CH4 Messgerät (%)
LAMBDA METHAMETER für Laborfermenter misst die Methan-Konzentration (0 – 100 % CH4)
Mehr
METHAMETER – CH4 Messgerät (%)
LAMBDA METHAMETER für Laborfermenter misst die Methan-Konzentration (0 – 100 % CH4)
Mehr
 Zusätzliche PRECIFLOW Pumpenlinie
PRECIFLOW Schlauchpumpe 0-600 ml/h, Kabel, Flasche mit Kanüle, Anschlüsse, Filter und Schlauch.
Mehr
Zusätzliche PRECIFLOW Pumpenlinie
PRECIFLOW Schlauchpumpe 0-600 ml/h, Kabel, Flasche mit Kanüle, Anschlüsse, Filter und Schlauch.
Mehr
 Zusätzliche MULTIFLOW Pumpenlinie
MULTIFLOW Schlauchpumpe 0-600 ml/h, Kabel, Flasche mit Kanüle, Anschlüsse, Filter und Schlauch.
Mehr
Zusätzliche MULTIFLOW Pumpenlinie
MULTIFLOW Schlauchpumpe 0-600 ml/h, Kabel, Flasche mit Kanüle, Anschlüsse, Filter und Schlauch.
Mehr
